帕金森氏病 (PD) 是一種進行性神經退行性疾病,其隱含特征是黑質致密部 (SNpc) 中多巴胺能 (DA) 神經元逐步喪失,并明確表現為運動遲緩、強直、靜止性震顫和姿勢不穩。
目前,可用的治療方法主要是姑息策略,包括 L-3,4-二羥基苯丙氨酸 (L-DOPA) 替代療法、DA 受體激動劑和深部腦刺激 (DBS) 程序。然而,隨著疾病的進展,藥物治療效果不可避免地會消失,更糟糕的是,運動反應振蕩的副作用以及 L-DOPA 誘發的運動障礙 (LID)。因此,上述令人沮喪的狀況推動了向細胞替代療法 (CRT) 的轉變,一種有前途的恢復療法,旨在確保患者癥狀的持久緩解。
2016年5月31日,華中科技大學同濟醫學院在國際期刊《Parkinson’s disease and age-related movement disorders》上發布了一篇《帕金森病干細胞制備及應用概述:現狀及未來前景》的研究結果。

目前,研究最多的用于DA神經元衍生的干細胞來源是人胎兒腹側中腦(hfVM)細胞、人胚胎干細胞(hESCs)、人神經干/前體/祖細胞(hNSCs/hNPCs)、人間充質干細胞(hMSCs)、人誘導神經干細胞 (hiNSCs) 和人誘導多能干細胞 (hiPSCs),它們有望成為恢復性治療方案(見圖1)。關于PD,估計SN中 30%的DA細胞損失以及紋狀體DA神經元神經支配減少60%以上可導致臨床特征的出現。
因此,任何類型的CRT方案都需要將黑質紋狀體系統至少恢復到正常水平的30%才能有效。為了保證未來基于干細胞的CRT的標準化和均質化,理想的評估標準應符合以下協議:
1. 產生足夠的可用于移植的神經譜系特異性細胞系;
2. 植入后細胞的持續存活(即數年);
3. 分化成足夠數量(大約 100,000 個)的黑質 DA 神經元,并有證據表明移植細胞釋放多巴胺;
4. 這些細胞移植后的行為恢復;
5. 沒有證據表明腫瘤形成或分化為進一步破壞黑質紋狀體回路的神經元/細胞;
6、符合藥品生產質量管理規范(GMP)標準;
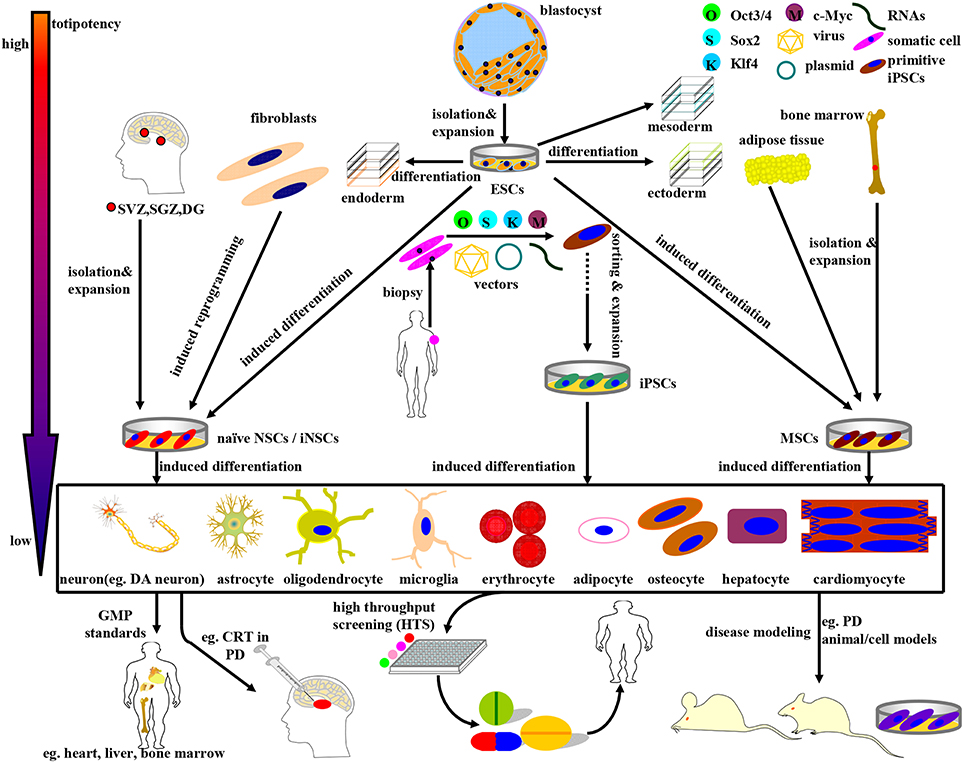
上述干細胞可分為ESCs、NSCs、MSCs和iPSCs四大類,伴隨著逐漸下降的全能性。
在這篇綜述中,我們建議詳細介紹干細胞系的制備和應用,尤其是用于PD研究和治療的ESC、NSC/NPC、iNSC、MSC和iPSC(見圖1)。由于更優越的多能性、更獨特的分化特征和更多認可的來源,iPSC似乎是更優先的CRT候選者。此外,還將闡述PD患者實用干細胞治療的現狀、未來前景和CRT相關炎癥問題。
胚胎干細胞 (ESC)
ESCs來源于發育中囊胚的內部團塊,在某些正常情況下具有自我更新和產生所有三個主要胚層——外胚層、中胚層和內胚層的細胞的潛力(見圖1)。
在體外誘導ESC進一步分化的嘗試涉及幾種不同的方法(參見圖2)。
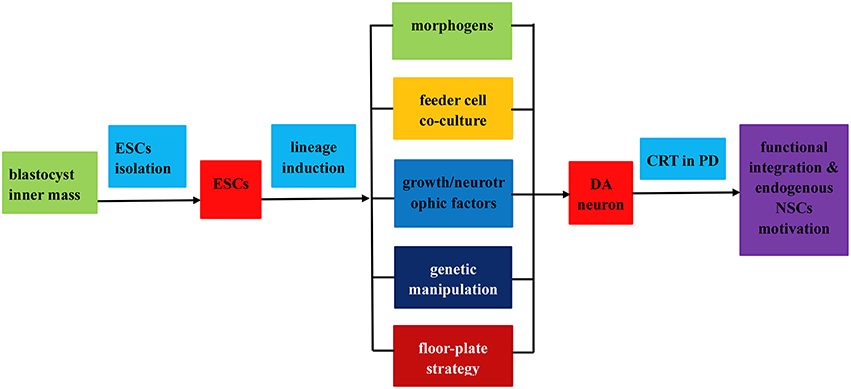
整個過程分為以下三個步驟: (1) 從胚泡內塊分離胚胎干細胞;(2) 通過 (i) 應用形態發生素或可溶性生長因子誘導ESC分化為DA神經元;(ii) 飼養細胞共培養;(iii) 遺傳操作;(iv) 底板譜系誘導策略;(3) 通過功能整合和內源性NPCs動機在PD治療中移植誘導的DA神經元。
例如,通過應用多種形態發生素如全反式維甲酸 (RA)、聲波刺猬 (SHH)、成纖維細胞生長因子 (FGF)、表皮生長因子 (EGF)、骨形態發生蛋白,顯著改善了神經譜系誘導(BMPs) 和神經膠質細胞衍生的神經營養因子(GDNF)所有這些都用作神經源性刺激物,這對于正常的胚胎發育和分化也是必不可少的(見表1)。
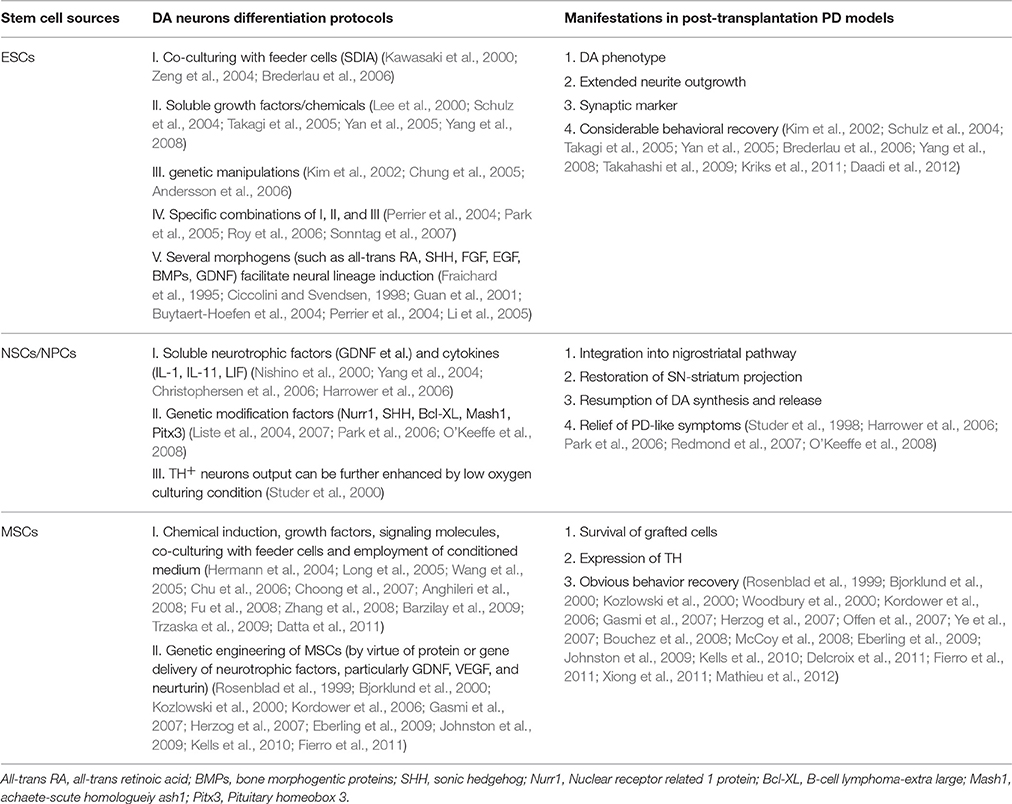
到目前為止,已有多項證據表明,源自ESC的富含DA的移植物在移植到PD動物模型后通常保持其DA誘導的表型、延長的神經突向外生長、表達突觸標記并產生相當大的行為恢復(見表1)。與PD動物模型的結果類似,接受人類胎兒組織移植的患者表現出運動缺陷顯著減少,移植物存活率、多巴胺釋放和DA神經元的突觸整合。
主要問題
然而,與所有多能干細胞的情況一樣,hESC 可能會在預期的移植區域產生畸胎瘤。此外,移植的胚胎干細胞可能會穿過血腦屏障,在功能上整合到異位腦區并分泌活性因子,從而對中樞神經系統(CNS)產生不良影響。此外,同種異體 hES 細胞及其衍生物在移植到受體大腦中時可能會引起免疫排斥反應。除此之外,移植物引起的肌張力障礙和運動障礙是另一個棘手的問題。針對以上擔憂,未來的干細胞研究可以做些什么呢?
總的來說,必須通過熒光激活細胞分選 (FACS)、磁激活細胞分選 (MACS)、有絲分裂阻滯和/或定向分化等方法,從最終移植產品中去除或減少殘余ESC至安全水平,以便減少致瘤危害。此外,對移植細胞生物分布、潛在異位毒性的評估以及對ESC衍生細胞的免疫狀態和經歷神經退行性損傷的CNS的了解將更好地保證基于 ESC 的 CRT 在PD中的成功。遺憾的是,由于上述潛在問題,到目前為止,還沒有美國食品和藥物管理局 (FDA) 批準使用 hESC 衍生細胞在 PD 患者中進行移植的正在進行的臨床試驗。然而,鑒于迷人的內在分化能力和全球研究人員的共同努力,hESCs 衍生的 DA 神經元必將達到臨床階段并轉化為臨床應用。
神經干細胞 (NSC)
1990年代早期在成年哺乳動物中樞神經系統中發現干細胞和祖細胞,挑戰了著名科學家 Ramony等人長期存在的“無新神經元”學說。打開神經干細胞用于PDCRT的潛力的窗口。NSCs是干細胞的一種亞型,能夠在胚胎和成人中自我更新并產生神經系統的主要表型,致力于神經譜系分化,并可能在體內形成神經元、少突膠質細胞和星形膠質細胞。
神經干細胞移植在帕金森病治療中的制備(直接分離或誘導分化)和各自應用的流程圖
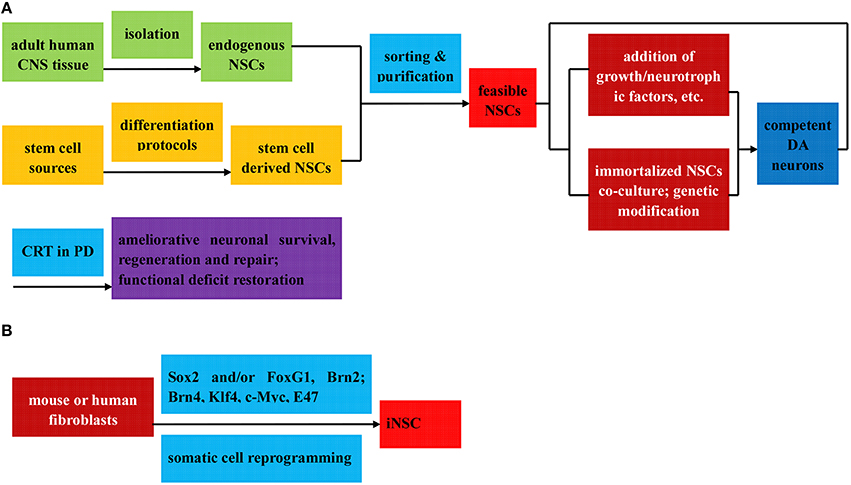
NSCs可分為三類:(1)內源性NSCs,直接從成人CNS組織中分離(A);
(2) 干細胞衍生的NSCs,通過不同的分化方案從各種干細胞誘導(A);
(3) iNSC,由Sox2從小鼠或人成纖維細胞重新編程,有或沒有其他轉錄因子(B); 所有這些都可以進一步分選和純化以獲得可行的NSCs。
其中,干細胞衍生的神經干細胞可以通過以下兩種方案進一步誘導分化為多巴胺神經元:(i)添加生長因子、神經營養因子、細胞因子等。培養基誘導神經球形成;(ii) 與永生化 NSC 系共培養以引入基因修飾因子。當將上述可行的NSCs和感受態DA神經元應用于PD的CRT治療時,可以觀察到改善的神經元存活狀態和恢復性功能缺陷。
PD是一種與衰老相關的神經退行性疾病,被認為是受影響大腦區域NSCs池缺乏的結果,是CRT的合適候選者。因此,高度期待將NSCs(內源性NSCs、iNSCs或干細胞衍生的神經干細胞)替換到受損大腦中作為PD的可能治療手段(見圖1)。在成功建立多種來源的神經干/前體/祖細胞 (NPC/NSC) 后,快速、可靠和長期生產人類NPC對神經科學家和臨床神經移植試驗都具有巨大的實用價值。
PD是一種與衰老相關的神經退行性疾病,被認為是受影響大腦區域NSCs池缺乏的結果,是CRT的合適候選者。因此,高度期待將NSCs(內源性 NSCs、iNSCs或干細胞衍生的神經干細胞)替換到受損大腦中作為PD的可能治療手段(見圖1)。在成功建立多種來源的神經干/前體/祖細胞 (NPC/NSC) 后,快速、可靠和長期生產人類 NPC 對神經科學家和臨床神經移植試驗都具有巨大的實用價值。
間充質干細胞 (MSC)
MSCs是一種非造血多能亞型細胞系,主要來源于骨髓的基質結構 ,而不是脂肪組織、臍帶、真皮和外周血,在體內一般分化為骨細胞、軟骨細胞和脂肪細胞(見圖1)。
一般而言,有兩類MSC:天然MSC(直接從間充質組織分離)和神經誘導的MSC,它們都對PD治療具有巨大前景(見圖4)。其中,天然骨間充質干細胞(BMSCs)和神經誘導骨間充質干細胞(BMSCs)均已通過多組PD模型的治療效果測試,均顯示移植細胞存活、TH表達和明顯的行為恢復,但神經誘導的 BMSCs 的修復效果似乎更明顯。此外,從脂肪組織和臍帶中分離出的MSCs在PD模型中同樣顯示出有益效果。此外,基因工程MSCs也被證明在PD治療中表現出治療潛力。大量研究表明,生長因子(特別是 GDNF、VEGF 和神經營養因子)的蛋白質或基因遞送在一系列嚙齒動物和靈長類PD模型中有效保護多巴胺神經元(見表1)。

MSCs可分為三種類型:na?veMSCs、神經誘導的MSCs和基因工程的MSCs,它們都可以在移植后直接發揮內在治療作用,例如(i)分泌中性粒細胞因子、生長因子等;(ii) 內源性 MSCs 動機、神經發生和血管生成;(iii) 免疫調節和抗炎作用。
此外,MSCs可以通過(i)化學刺激誘導分化為多巴胺神經元;(ii) 基因轉染;(iii) 飼料細胞共培養;(iv) 使用條件培養基。移植后,MSCs 和分化的 DA 神經元表現出 (a) 在毒素損傷后持續的神經元存活;(b) 增強多巴胺神經元再生和修復;(c) 功能缺陷恢復。
迄今為止,有以下幾種可能的潛在機制解釋了MSC 對PD的治療效果(見圖6)。
1. 分泌各種生長因子、細胞因子、細胞外基質 (ECM) 蛋白和有效的神經調節分子,為神經再生創造有利環境。
2. 激活內源性恢復機制以促進神經發生、血管發生并減少 DA 神經元的損失(抗細胞凋亡)。
3.免疫調節和抗炎作用。
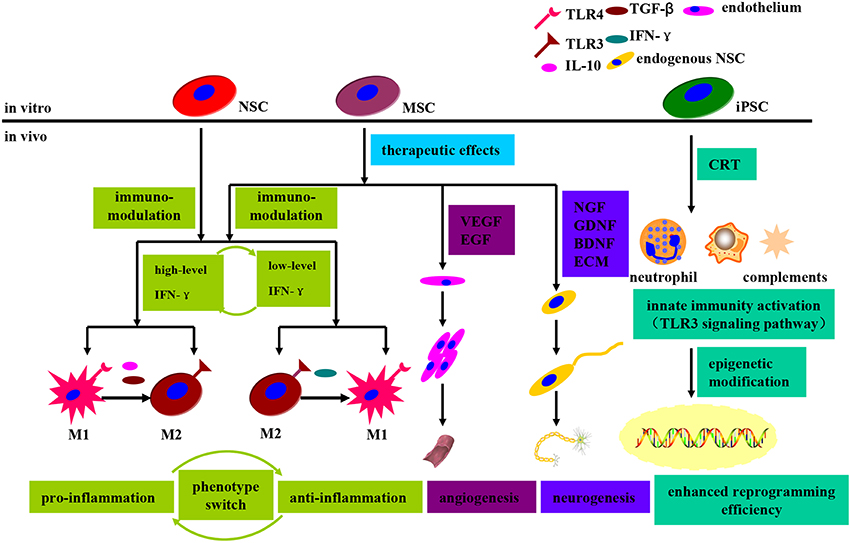
現狀與未來展望
作為一種有前途的恢復性治療替代方案,干細胞療法作為一種有前途的再生療法已成為PD研究領域的前沿,尤其是與MSC相關的療法。一方面,MSC可以很容易地獲得和擴展,而無需使用其他支持性細胞。另一方面,MSC不受與ESC相關的倫理和免疫排斥問題的影響。
遺憾的是,觀察到的MSCs衍生神經元和神經膠質細胞的數量相當少,無法恢復正常的細胞結構,盡管一些體內研究表明MSCs能夠在移植后分化為神經元細胞。因此,如何在未來的研究中產生足夠多且特異的神經元或膠質細胞亞型以適應細胞移植是一個需要理順的首要問題。與ESC和NSC的情況一樣,應解決與腫瘤形成、免疫排斥和生物分布相關毒性相關的安全問題,以便最終將MSC轉化為PD治療選擇。我們相信,盡管MSC研究仍處于臨床管道的啟動階段,但 MSC 很有希望成為可用于PDCRT的干細胞庫的成員。
誘導多能干細胞 (iPSC)
2006年Yamanaka 等人已經表明,ESC樣細胞可以通過逆轉錄病毒引入OSKM基因轉錄因子從胚胎和成年小鼠成纖維細胞中衍生出來,后來獲得諾貝爾獎獎勵“發現成熟的體細胞可以重新編程以重新進入多能性”。從重編程過程中獲得的類ESC多能細胞被稱為iPSC(見圖1)。
與其他類型的干細胞相比,iPSCs憑借更優越的多能性、更獨特的分化特征和更容易獲得的來源,似乎是更優先的CRT候選者。下文將進一步闡述多種多樣的iPSCs的制備、應用、現狀、潛在挑戰和未來前景。
iPSCs在帕金森病中的應用
研究表明,基于蛋白質的人類iPSC很有希望成為臨床轉化的有前途的細胞來源,這些hiPSC的行為與hESC相似,沒有異常衰老/細胞凋亡,沒有顯示任何外源性重編程基因表達,并且DA神經元來自人類piPSC顯著改善PD嚙齒動物模型中的行為缺陷(參見表3)。總之,對于與PD相關的干細胞研究和治療領域,除了現有的基于病毒和蛋白質的iPSCs外,還應將更多的精力和注意力投入到多元化建立的iPSCs上,這將極大地促進CRT的進一步發展如果實施,用于PD治療。

現狀與未來展望
一般來說,理想的iPSCs的建立集中在適用的體細胞來源、重編程因子的適當組合、有效的遞送方法和適當的培養條件。根據iPSC的目的和應用,有關體細胞類型、重編程因子、遞送方法和培養條件的選擇在很大程度上有所不同,其中詳細闡述了重編程因子和遞送載體。在上述協議的基礎上,已經成功地建立了從各種體細胞到iPSC的轉分化,并且iPSC衍生的DA神經元也被證明可以挽救PD動物模型中的運動缺陷。盡管取得了上述成就,但臨床上可行的iPSC的生成仍然存在局限性。
用于帕金森病治療的干細胞亞型的優缺點
胚胎干細胞、神經干細胞、間充質干細胞和iPSC等多種類型的干細胞已應用于PD相關的基礎和實驗研究,其中許多已轉化為PD模型移植,結果參差不齊。分別闡述了上述干細胞的制備、誘導分化、初步應用、當前挑戰和未來前景。然后比較干細胞亞型在PD治療中的優缺點(見表4)。
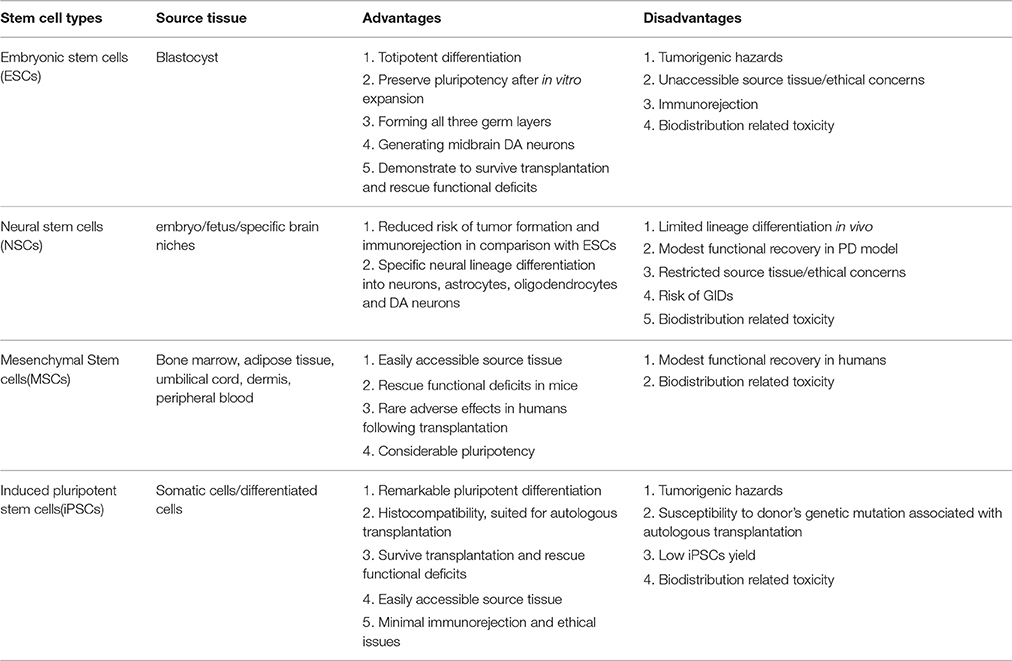
ESCs來源于囊胚的內細胞團,可以全能分化為三個胚層,包括黑質DA神經。此外,ESCs衍生的DA神經元在移植到PD動物模型后已證明,神經突長出延長,特定突觸標記物的表達和功能缺陷的緩解。然而,將這些細胞用于PD治療仍然存在一些嚴重的問題,例如腫瘤形成的風險、倫理問題和免疫排斥,因此需要更多的研究以保證在PD治療中的進一步應用。
至于NSC,與ESC相比的一個潛在優勢是,除了神經譜系分化受限外,它們在移植后不易形成腫瘤和引起免疫排斥反應。然而,神經干細胞顯示出一些缺點,如有限的分化能力和來源、揮之不去的倫理問題、帕金森癥狀的部分緩解。
相比之下,一些研究表明,間充質干細胞沒有上述缺點,可能對神經系統疾病具有更大的治療潛力。
結論
盡管細胞替代療法是治療帕金森和其他神經退行性疾病的有前途的途徑,但仍然存在許多障礙,如腫瘤發生、免疫反應、低干細胞產量和生物分布相關的毒性,有待解決,以便能夠開發出可以轉化為有效且普遍接受的臨床應用的新方法。除此之外,疾病階段和嚴重程度也可能對細胞替代療法的效果產生影響。總之,細胞替代療法實踐仍處于起步階段,因此我們必須在未來的研究中建立更多的干細胞系,以推動與帕金森病相關的干細胞研究和治療從實驗室到臨床。




 掃碼添加微信
掃碼添加微信