簡介:干細胞的特點是能夠分化成不同的細胞類型,同時保留自我復制和維持親代細胞特征的能力。干細胞分化成特殊細胞類型的這種不同能力被稱為效力。根據它們的效力,各種類型的干細胞如圖1所示。在細胞潛能譜中,可以分裂和分化成任何胚胎細胞類型以及胚外細胞的細胞被稱為全能細胞。在人類發育模型中,全能細胞起源于受精卵,受精卵是單一的全能細胞。隨著受精卵在受精后的幾天內分裂,相同的子細胞在囊胚形成之前保持全能。在此階段,內部細胞團開始分化,此后細胞被認為是多能的。
干細胞療法:一種有望治愈各類疾病的方法
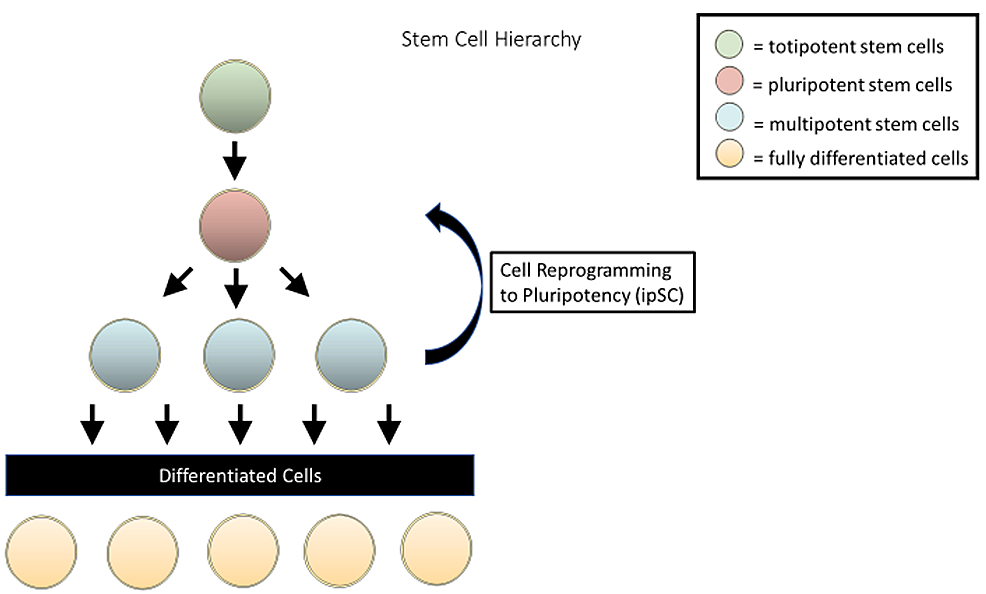
多能細胞可以產生屬于三個胚層(內胚層、中胚層、外胚層)中任何一個的細胞,但缺乏分化成胚外細胞的能力。在進一步成熟和分化后,干細胞從多能變為多能。盡管多能細胞仍然能夠分化為少數離散的細胞類型,但它們僅限于彼此相關的細胞類型(例如,神經干細胞、間充質干細胞)。
干細胞類型有哪些
體內干細胞根據其來源可大致分為三種類型:胚胎(ESCs)、胎兒(FSCs)和成體干細胞(ASCs,其中間充質干細胞或MSCs)。
胚胎干細胞 (ESC) 來源于受精后著床前胚胎(稱為囊胚)的內細胞團。這些在胚泡的內細胞團中發現的多能細胞增殖并分化成構成生物體的不同細胞類型。
胎兒干細胞 (FSC) 是位于胎兒組織中的多能細胞。
成體干細胞 (ASC) 是存在于全身各種組織中的多能細胞。與 ESC 和 FSC 不同,它們也稱為成體干細胞,可以在幼年和成年動物以及人類中找到。
人類干細胞的另一個豐富來源是臍帶血。這些多能干細胞可以在臍帶血和組織(沃頓氏膠)中找到,它們與FSC一起被稱為圍產期干細胞。鑒于干細胞平臺的治療潛力,臍帶血庫越來越多地被吹捧為治療人生命后期可能出現的疾病的可行選擇,臍帶血也用于移植以克服人類白細胞抗原 (HLA) 不相容性。
盡管多能成體干細胞的分化能力有限,但已經開發出克服這些障礙的方法。
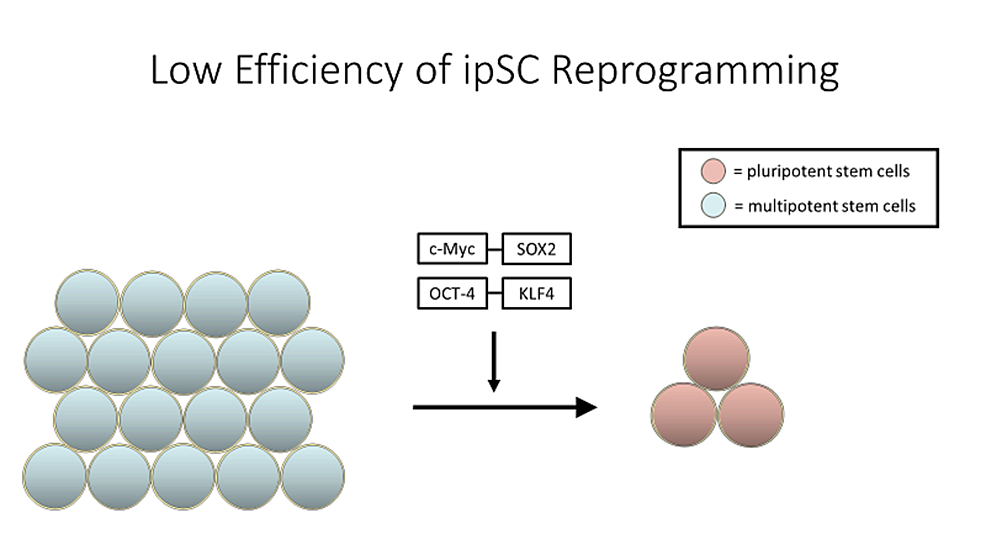
誘導多能干細胞 (iPSC) 是經過人工重新編程以表現得像胚胎干細胞的成體細胞,如圖2所示。通過引入一組特定的轉錄因子,體細胞能夠恢復其多能性,從而賦予它們巨大的治療潛力。
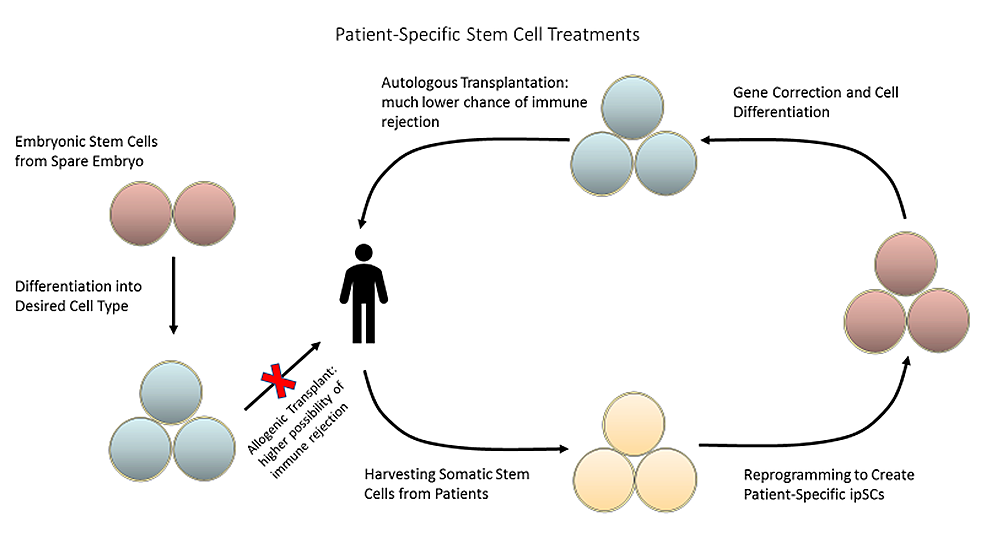
干細胞作為治療各種疾病的臨床應用
基因工程的最新進展賦予我們改變細胞的能力,最顯著的是干細胞,以允許非常具體和有效的目標功能的方式。盡管如此,未經修飾的干細胞仍然具有巨大的治療潛力,并經常用于現代療法。
再生醫學
由于干細胞技術的最新進展,我們現在能夠更有效地研究人類疾病的機制。這開創了再生醫學的新紀元,超越了早期基于細胞的療法,并朝著評估人類遺傳變異和確定導致疾病的分子途徑以及治療靶點的方向發展。
干細胞療法與缺血性心肌病
心血管疾病仍然是美國的主要死亡原因。在過去十年中,干細胞已成為慢性損傷組織的潛在治療劑,MSC被廣泛研究用于此類治療。初步結果表明,在修復和生成心臟組織方面取得了可喜的成果。
一項雙盲、安慰劑對照研究在53名MI后患者中使用了靜脈內同種異體人MSC,兩組之間的不良事件相似。動態心電圖顯示,在接受MSC輸注的組中,室性心動過速發作次數減少,肺功能測試的一秒內用力呼氣量有所改善。MSC組的整體癥狀評分和射血分數均有顯著改善。在另一項研究中也看到了類似的結果,其中MSC注射導致缺血性心肌病患者的功能能力、生活質量和心室重構得到改善。
干細胞療法與肌肉骨骼疾病
干細胞療法也為肌肉骨骼疾病的治療提供了新的前景。由于干細胞的多向分化能力,可以修飾各種因素以促進干細胞分化和生長成由不同細胞類型組成的復雜組織。已經開發出各種技術來為干細胞創造合適的微環境來調節它們的行為和命運。這包括支架的組成、生長因子和氧分壓。在頜面部疾病/缺陷的治療中,也正在積極研究基于干細胞的療法。至少有44項正在進行的與口腔干細胞和口腔疾病相關的注冊臨床試驗。

干細胞療法可以針對骨關節炎的不同階段進行設計。早期治療側重于內源性干細胞的操作和關節內干細胞注射,而后期治療側重于關節表面置換。這些治療的主要目標是啟動軟骨形成。一些正在進行的值得注意的臨床試驗正在利用來自骨髓的自體干細胞并將它們移植到關節間隙中。另一項已發表的試驗研究了13名平均年齡為50歲的患者,他們接受了關節內干細胞注射。連續隨訪的 MRI 掃描顯示,經治療的關節軟骨的健康和質量得到改善。

干細胞療法與視網膜疾病
對于眼科醫生來說,退行性視網膜疾病是治療最具挑戰性的疾病之一。缺乏可靠的選擇往往意味著患者得不到針對這些使人衰弱的疾病的充分治療。目前正在研究干細胞作為視網膜疾病的治療方法。它們的分化和自我更新能力表明它們有可能催生出新穎、更有效的視網膜疾病治療方法,并可能在未來逆轉失明。在初步研究顯示有希望的結果后,第二項基于干細胞的眼科治療研究啟動,目前正在進行中。干細胞工作的建議模型包括干細胞遷移到受傷區域,以及它們分化為視網膜色素細胞。
干細胞療法自身免疫性疾病
多項研究表明,干細胞基于它們與先天免疫系統和適應性免疫系統的細胞成分的相互作用而表現出免疫調節特性。
干細胞療法與1型糖尿病:大多數1型糖尿病病例是由T細胞介導的自身免疫攻擊引起的,這會導致β細胞遭到破壞,從而導致無法自然產生胰島素。這使得患者在他們的余生中依賴于外源性胰島素。幾項旨在通過基于干細胞的療法替代丟失的β細胞的研究取得了一些成功。
最近的一項研究比較了胰島素依賴型糖尿病動物模型中的iPSC和MSC移植。這項研究表明,iPSC移植通過胰島的新生啟動了內源性胰腺再生,并得出結論,基于iPSC的療法可以為1型糖尿病患者帶來希望。

盡管β細胞替代可能有效,但人們擔心最初破壞患者β細胞的相同自身免疫反應可能再次發生。另一種稱為“干細胞教育者療法”的方法已被開發出來,通過采用干細胞療法來調節患者的自身免疫反應,并產生了可喜的結果。患者的血液通過閉環系統循環以分離淋巴細胞。然后將它們與人臍帶血衍生的多能干細胞共同培養并返回給患者。初步結果表明,胰島細胞引發的自身免疫反應被逆轉,并觀察到胰島細胞再生。
干細胞療法與類風濕性關節炎:疾病緩解抗風濕藥 (DMARDs) 加不含干細胞的培養基與DMARDs加臍帶間充質干細胞 (UC-MSC) 靜脈內給藥的比較顯示沒有嚴重的副作用,TNF-α和IL的血清水平-6被觀察到在第一次治療后有所減少。根據美國風濕病學會的改善標準、28關節疾病活動評分和健康評估問卷,以干細胞為基礎的治療導致疾病顯著緩解,而對照組沒有顯示出這種益處。

干細胞療法與系統性紅斑狼瘡:對SLE和抗磷脂綜合征中自體造血干細胞移植 (HSCT) 研究的回顧評估了25項研究。大多數研究報告說,與單獨的免疫抑制相比,HSCT后有改善,這是通過系統性紅斑狼瘡疾病活動指數 (SLEDAI) 或無病時間進行評估的。

多發性硬化癥是一種以功能進行性下降為特征的脫髓鞘疾病,對患者來說是一種毀滅性的疾病,但干細胞平臺可以應用于此。最近的一項試驗招募了20名接受臍帶間充質干細胞治療的受試者,并對他們進行了為期一年的隨訪。患者的 EDSS 評分在統計學上有顯著改善 (p<0.03) 。
ALS 是另一種使人衰弱的疾病,可以從使用基于干細胞的療法中獲益。到目前為止,已經使用兩種不同的方法來治療這種疾病:一種方法是使用干細胞再生運動神經元并替換隨著疾病進展而丟失的細胞;另一種方法是使用干細胞再生新的星形膠質細胞,以取代功能失調的細胞,這些細胞負責導致神經元死亡的有毒環境。這些試驗,其中大部分是鞘內施用干細胞,正在利用造血干細胞、間充質干細胞和神經元干細胞來實現其目標。
干細胞療法與腦損傷
因多種因素,如產道擠壓、外傷、產程過長、圍生期窒息等,所導致的新生兒腦損傷,其中缺血缺氧性腦病是新生兒腦癱的最常見病因。新生兒腦癱可遺留永久性腦損害,如癱瘓、癲癇、智力低下、視聽障礙、語言障礙等,給社會和家庭帶來了極大的負擔。目前對新生兒腦癱的治療尚無特效藥,臨床上主要是對癥支持治療以及后期的康復訓練,整體治療效果較差。
因MSCs具有多向分化的潛能、造血支持、促進干細胞的植入、免疫調控等特點而備受關注,成為腦癱治療的“明星細胞”之一。

中國人民解放軍第211醫院神經外科團隊[2]對40例腦癱患兒進行臍帶間充質干細胞治療,療程結束后發現,和患兒自身對比的粗大運動能力均得到不同程度提高,尤其是仰臥位與俯臥位、坐位、爬與跪、行走方面,跑跳功能方面也有明顯改善; 而且在患兒出院后6 個月至1 年期間內,仍能維持長期的療效。同時,干細胞移植治療也明顯降低患兒的肌張力。
干細胞治療是腦癱的治療方法之一,也是治療腦癱的研究方向之一,目前在臨床研究和實驗研究方面取得了令人矚目的成績,為腦癱患者帶來了新的希望。
干細胞療法與神經變性疾病
神經變性疾病是一類以神經細胞變性或凋亡為特征的慢性神經系統的疑難雜癥,包括肌萎縮側索硬化癥、帕金森病、阿爾茨海默病等。
近年來干細胞的研究為神經修復和再生提供了一條新的途徑,是神經變性疾病治療的有效方法之一。MSCs具有干細胞的特征,具有多向分化的潛質,在一定的誘導調節下可分化為神經干細胞和神經元,同時來源廣泛、免疫原性低、無倫理限制、培養擴增簡單,是治療神經變性疾病的首選之一。
國內在MSCs移植治療帕金森的臨床研究也已取得了許多可喜的臨床效果,已查詢到多篇應用間充質干細胞治療帕金森疾病的臨床研究文獻,可以看出MSCs在顯著改善患者的運動癥狀,提高的生活質量,延緩病情發展都有顯著的效果。
2015年,鄭州大學第一附屬醫院使用400萬個胚胎干細胞來源的神經前體細胞移植到帕金森病患者體內,這是全球首個使用受精胚胎的胎盤干細胞治療帕金森病的臨床試驗,此項目是中國在2015年通過的第一批干細胞臨床試驗,旨在確保干細胞能夠安全和符合倫理標準的前提下應用于臨床。
2018年10月,日本批準了誘導多能干細胞治療帕金森病的臨床試驗。日本京都大學醫院將240萬個誘導多能干細胞來源的前體細胞移植入一名帕金森病患者腦內,進行了全球首例誘導多能干細胞治療帕金森病的臨床試驗。
因此MSCs在治療神經變性疾病中逐漸顯示出治療的優勢和臨床價值,是一種行之有效且安全性高的治療手段,具有巨大的臨床應用潛力,有望成為治愈神經變性疾病的手段之一。
干細胞療法與神經損傷性疾病
近年來脊髓損傷和顱腦創傷的發病率逐年上升,傳統的治療措施為手術與神經營養和康復訓練相結合,對患者的康復有一定的治療作用但周期長難度大。
干細胞治療除運動功能、感覺功能有相當的改善外,患者汗腺分泌障礙、直立性低血壓亦得到緩解,這些治療效果是傳統的治療方法所不能實現的,因此細胞治療在神經損傷性疾病的治療中有著獨特的優勢。
研究證實,MSCs可以在宿主體內存活并分化為具有神經細胞特征的細胞,實現損傷細胞的替代,從而為神經功能的再建奠定物質基礎。MSCs來源豐富、獲取簡單、增殖快、干性強,經誘導可分化為神經元和神經膠質細胞,現已經成為神經干細胞移植治療神經損傷策略中的“明星細胞”和“種子細胞”。

2018年,空軍總醫院與北京放射與輻射醫學研究所公布了臍帶間充質干細胞鞘內注射治療脊髓損傷的長期臨床觀察結果。22例有效SCI患者接受臍帶間充質鞘內注射治療,結果表明UC-MSCs鞘內注射治療是安全的,可改善大部分不完全性SCI患者的神經功能,多療程治療有可能使患者療效得到進一步提高。
挑戰
雖然基于干細胞的療法可用于有效治療無數人類疾病,但它們并非沒有挑戰。
干細胞的致瘤性
干細胞的定義是它們自我更新和分化成各種細胞類型的能力:這些特性使它們成為潛在替代患病或受損組織的理想選擇。然而,這些相同的特性導致了它們的致瘤潛力。許多研究都強調了干細胞平臺的致瘤性風險,包括美國食品和藥物管理局 (FDA) 批準的首次人體誘導多能干細胞 (iPSC) 臨床試驗的臨床前劑量遞增試驗2009 年。在接受人類ESC衍生的神經祖細胞的小鼠中觀察到再生脊柱組織中的囊腫,導致在任何人類受試者接受治療之前暫停研究一年。
治療耐久性
盡管針對癌癥的靶向干細胞療法最初具有很強的治療效果,但通常會出現復發。因此,僅僅基于干細胞的療法可能不足以根除腫瘤。為了使患者獲得最大的治療益處,這些靶向治療往往與其他合理選擇的治療相結合。兩項正在進行的臨床試驗正在研究神經干細胞在人類多形性膠質母細胞瘤 (GBM) 中的作用,結果將提供令人興奮的臨床反饋。
道德考量
人類胚胎干細胞 (hESC) 于1998年首次從一對夫婦捐贈的胚胎中分離出來,他們不再希望將其用于不孕癥治療。從那時起,hESC 研究一直是一個有爭議的話題,這是社會對科學范圍的潛在恐懼的一部分,涉及人類克隆和人類生物材料的商品化。然而,大多數關于在研究中使用 hESC 的擔憂源于人類胚胎的破壞。
最近,干細胞研究中出現了一種新的研究監督系統。美國國家科學院和國際干細胞研究學會 (ISSCR) 鼓勵所有從事多能干細胞研究的研究人員讓他們的研究獲得干細胞研究監督委員會 (SCRO) 的批準。SCRO由科學家、醫生、倫理學家、法律專家,甚至社區成員組成。SCRO確保滿足當地的道德要求,獲得捐贈者的自愿知情同意,并公平對待包括胚胎在內的人體材料的捐贈者。
成本
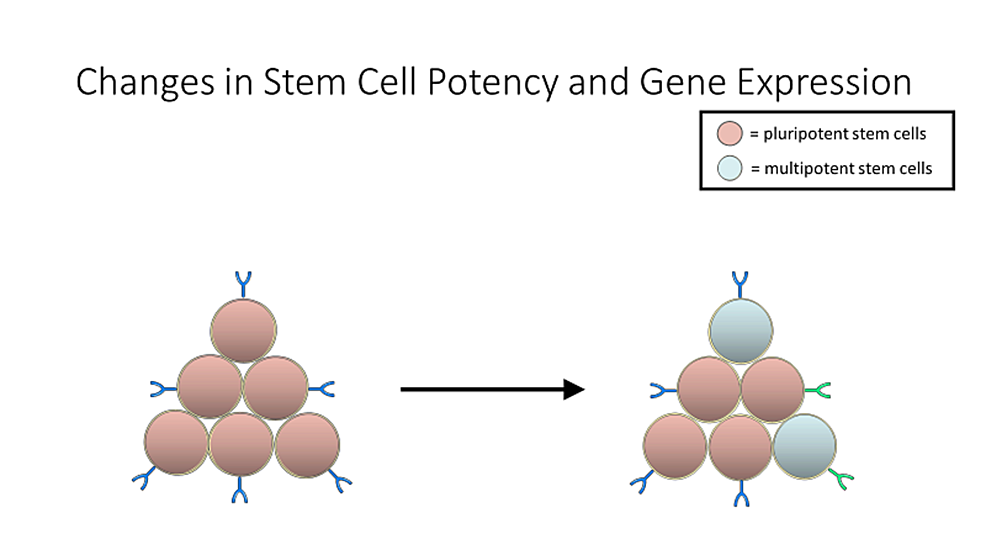
阻礙基于干細胞的療法和研究成為主流的最大障礙之一是成本。人類iPSC的每個細胞系都需要兩到四個月的時間來發育,從收集原代細胞開始,然后重新編程,效率約為0.01%到0.1%(圖3),并長成相當大的iPSC群體。此外,將細胞長時間培養以重新編程 iPSC也會導致基因表達效力發生變化(圖4 )。這可能會導致細胞無法用于治療目的,因此必須對這些細胞進行分類。因此,開發臨床iPSC衍生組織產品非常昂貴(約800,000美元),并且考慮到許多此類療法的不確定性和臨床數據的缺乏,有人可能會爭辯說這些療法無法實現或無法獲得。
結論
干細胞,由于它們的再生、轉化和歸巢特性,理論上有可能通過替換這些細胞來治愈任何涉及細胞病理學的疾病。它們不僅擁有更有效地治療自身免疫性疾病的能力,而且還可以幫助患有中風、癡呆、帕金森氏癥和糖尿病等慢性疾病的患者,并假設治愈長期以來被認為無法治愈的疾病的可能性。截至目前為止政府公布了500多項正在進行的涉及干細胞治療的臨床試驗,但我們距離其中許多療法可用于廣泛的臨床適應還很遙遠。盡管基于干細胞的療法伴隨著一系列挑戰和擔憂,并且它們需要聯合療法,但很明顯,干細胞是未來再生醫學前進的方向,具有巨大的臨床應用價值。
提示:本文內容僅供參考,不做為診斷依據,任何關于疾病的建議都不能替代執業醫師的面對面診斷。最終以醫生診斷為準,不代表本站同意其說法,請謹慎參閱,本站不承擔由此引起的任何法律責任。



 掃碼添加官方微信
掃碼添加官方微信