間充質干細胞(MSCs)目前被廣泛研究用于治療多種現有難治的疾病,目前,已在1000多項臨床試驗中被提出。用于治療糖尿病、克羅恩病、支氣管肺發(fā)育不良、多發(fā)性硬化癥、肝功能衰竭、慢性自身免疫性蕁麻疹、系統(tǒng)性紅斑狼瘡等患者。但是,在靜脈輸注間充質干細胞后,它們在體內的生存時間、效果持續(xù)時間以及如何發(fā)揮治療作用仍是讓很多人所關心的問題。本文將基于最新的科學研究,探討靜脈輸注干細胞在體內能存活多久?效果能持續(xù)多久?作用階段?這些問題,希望能對您有所啟發(fā)。
靜脈移植干細胞在體內能存活多久?效果能持續(xù)多久?作用階段?
一、間充質干細胞體內存活多久
MSCs在靜脈輸注后的生存時間受多種因素影響,包括給藥方式、細胞的種類和患者的個體差異因素。以下是一些相關研究的發(fā)現:
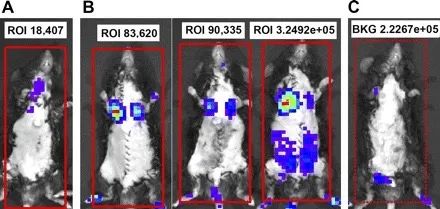
?2008 年《美國生理學腎生理學雜志》一文表明在靜脈輸注后10到15分鐘,通過生物發(fā)光對標記的MSC進行全身計數顯示,其強度在24小時后下降到大約60%,72小時后下降到不到10%。
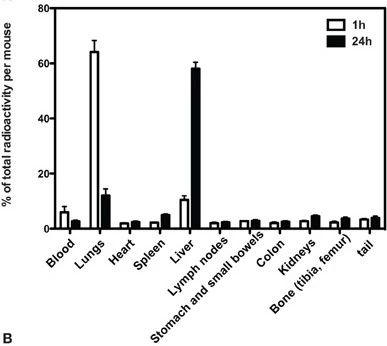
2012 年《前沿免疫學》 上的一項研究顯示,細胞輸注 1 小時后,大部分Cr-51(一種放射性標記物)被發(fā)現在肺部,而在24小時后,主要發(fā)現在肝臟。組織培養(yǎng)顯示,在輸注后24小時內,肺部仍然存在可活的供體MSC,但之后它們消失了。在檢查的其他器官中,都沒有發(fā)現活的MSC。細胞碎片可能被轉運到肝臟。

通過輸注,成人和新生人類來源的MSC可以在肌肉植入部位存活5個月,但在靜脈輸注、腹腔輸注或皮下輸注時只能存活1至4周。靜脈輸注、腹腔輸注、皮下輸注或肌肉植入后,觀察到3天內細胞存活率相當。

二、間充質干細胞的效果能持續(xù)多久
盡管MSCs在體內的生存時間相對較短,但它們的療效可能會持續(xù)較長時間,由于它們能夠調節(jié)免疫細胞的功能并促進修復過程。以下是一些研究發(fā)現:一項關于間充質干細胞治療的安全性研究顯示,在過去的15年中,MSCs在許多疾病(如心肌梗死、肝硬化、肢體缺血和脊髓損傷)中顯現出良好的治療作用。

在一項為期10年的隨訪研究中,研究人員觀察了靜脈輸注和腦脊液輸注人類臍帶間充質干細胞(hUC-MSCs)對復發(fā)性多發(fā)性硬化癥(RRMS)和神經脊髓炎(NMO)患者的長期安全性和可行性。

三、間充質干細胞的作用機制
間充質干細胞通過多種機制在體內發(fā)揮治療作用,以下是主要的幾點:
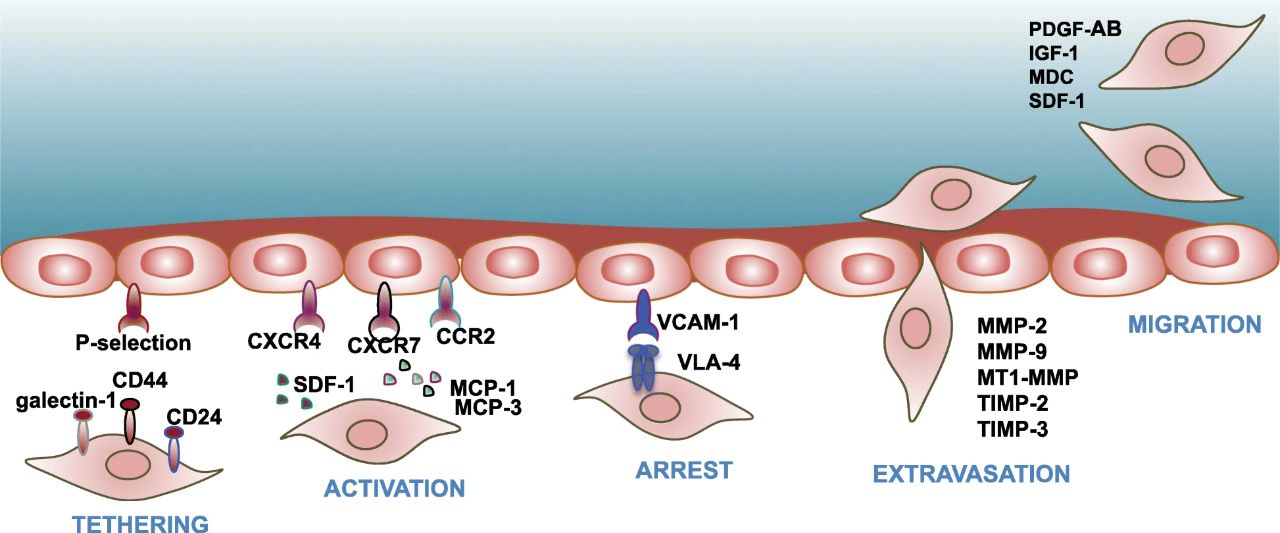
免疫調節(jié):MSCs具有強大的免疫調節(jié)功能,能夠影響多種免疫細胞的功能,包括T細胞、B細胞和自然殺傷細胞。通過抑制過度的免疫反應和促進免疫耐受,MSCs可以幫助治療各種免疫相關的疾病。
細胞因子、趨化因子和生長因子的分泌:MSCs能夠分泌多種生物活性分子,包括細胞因子、趨化因子和生長因子,這些分子可以促進組織修復和再生,抑制炎癥和纖維化,以及促進新血管生成。
外泌體(EVs)的產生:MSCs產生的外泌體是微小的囊泡,包含了蛋白質、RNA和DNA,它們可以傳遞信號并影響接受細胞的功能。通過外泌體,MSCs可以間接影響許多生理和病理過程,包括免疫調節(jié)和組織修復。
直接細胞與細胞的相互作用:MSCs可以直接與周圍細胞相互作用,包括免疫細胞、內皮細胞和其他細胞類型,從而影響它們的功能。
支持組織修復和再生:MSCs可以促進受損組織的修復和再生,例如,在心肌梗死或其他組織損傷后,MSCs可以通過促進新血管生成和抑制纖維化來支持組織修復。
四、間充質干細胞的起效階段
MSCs的作用機制通常是階段性的,而且可能存在一定的時間順序。以下是一個可能的時間順序和階段劃分:
初期階段(幾分鐘到幾小時):細胞定位和固定:MSCs在靜脈輸注后會迅速通過血流傳送到全身,并可能在特定的組織或損傷區(qū)域附著。
立即的生物活性物質釋放:MSCs能快速釋放一些生物活性物質,如細胞因子和生長因子,以開始調節(jié)炎癥和啟動修復過程。
中期階段(幾小時到幾天):持續(xù)的生物活性物質釋放:MSCs會繼續(xù)釋放生物活性物質,以促進細胞增殖、抑制炎癥和調節(jié)免疫反應。 外泌體的產生和釋放:MSCs產生外泌體,傳遞信號給周圍的細胞,促進組織修復和再生。

后期階段(幾天到幾周):細胞分化和組織修復:間充質干細胞可能會分化成其他細胞類型,如骨細胞或軟骨細胞,以支持組織的修復和再生。 長期的免疫調節(jié):通過初始的免疫調節(jié)效應,間充質干細胞可能會產生長期的免疫調節(jié)影響,從而改善免疫介導的疾病癥狀。
每個階段的持續(xù)時間可能會根據個體的條件和具體的治療協議而有所不同。間充質干細胞的生存時間可能較短,但它們產生的生物活性物質和外泌體可能會持續(xù)一段時間,從而使治療效果持續(xù)存在。同時,間充質干細胞所誘導的免疫調節(jié)和組織修復效應可能會有持續(xù)的影響,即使細胞本身已經消失。

結論
間充質干細胞的生存時間和效果持續(xù)時間是非常復雜且受多種因素影響的。然而,通過靜脈輸注間充質干細胞仍然顯示出對多種疾病的潛在治療效果。更多的研究和臨床試驗將有助于更好地理解間充質干細胞的生存時間、效果持續(xù)時間和作用機制,以及如何最大化利用這些細胞的治療潛力。
參考文獻:
Fischer, U. M., Harting, M. T., Jimenez, F., Monzon-Posadas, W. O., Xue, H., Savitz, S. I., … & Cox, C. S. (2009). Pulmonary passage is a major obstacle for intravenous stem cell delivery: The pulmonary first-pass effect. Stem Cells and Development, 18(5), 683-692. https://doi.org/10.1089/scd.2008.0253;.
Schrepfer, S., Deuse, T., Reichenspurner, H., Fischbein, M. P., Robbins, R. C., & Pelletier, M. P. (2007). Stem cell transplantation: The lung barrier. Transplantation Proceedings, 39(2), 573-576. https://doi.org/10.1016/j.transproceed.2006.12.012;.
Barbash, I. M., Chouraqui, P., Baron, J., Feinberg, M. S., Etzion, S., Tessone, A., … & Kedes, L. H. (2003). Systemic delivery of bone marrow–derived mesenchymal stem cells to the infarcted myocardium: Feasibility, cell migration, and body distribution. Circulation, 108(7), 863-868. https://doi.org/10.1161/01.CIR.0000084828.50310.6A;.
Squillaro, T., Peluso, G., & Galderisi, U. (2016). Clinical Trials With Mesenchymal Stem Cells: An Update. Cell Transplantation, 25(5), 829-848. https://doi.org/10.3727/096368915X689622;.
Wang, D., Zhang, H., Liang, J., Wang, H., Hua, B., Feng, X., … & Sun, L. (2019). A Long-Term Follow-Up Study of Allogeneic Mesenchymal Stem/Stromal Cell Transplantation in Patients With Drug-Resistant Systemic Lupus Erythematosus. Stem Cell Reports, 12(1), 2-10.
https://doi.org/10.1016/j.stemcr.2018.11.010;.
https://www.frontiersin.org/articles/10.3389/fimmu.2012.00297
免責說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構成任何臨床診斷建議!杭吉干細胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信