隨著21世紀細胞療法的迅速發展,間充質干細胞(Mesenchymal Stem Cells, MSCs)因其獨特的多向分化潛能和免疫調節特性,在治療多種難治性疾病方面展現了巨大的潛力。
2025年1月2日,中國國家藥監局(NMPA)批準鉑生卓越生物科技(北京)有限公司的艾米邁托賽注射液(商品名:睿鉑生)上市,中國迎來了第一款正式獲批的干細胞治療藥物。也標志著全球已有16款間充質干細胞藥物獲得批準上市。
- 詳情請瀏覽:開年重磅!國家藥監局批準我國首款干細胞藥品上市!
這些藥物不僅為某些傳統治療方法難以奏效的病癥帶來了新的希望,同時也引發了公眾對其成本效益和社會可及性的廣泛關注。本文將深入解析這些已上市間充質干細胞藥物的價格及其所能治療的具體疾病。

全球已獲批上市的16款間充質干細胞藥品價格與治療疾病全揭秘!
接下來,我們來盤點全球已知上市的16款間充質干細胞藥物。
其中,10款來源于骨髓,3款來源于臍帶,2款來源于脂肪,1款來源于臍帶血。
Mesoblast公司產品
1.Prochymal
從Prochymal到Ryoncil的研發歷程,歷經美國、加拿大、澳大利亞和日本,間隔12年,最終成為FDA批準的首款間充質干細胞藥物。
- 批準國家:加拿大
- 批準日期:2012年5月17日
- 細胞類型:骨髓間充質干細胞
- 適應癥:兒童急性移植物抗宿主病(GvHD)
- 價格:20萬美元/療程(通常4劑)
- 銷量:不詳
- 概況:Prochymal是一種即用型干細胞產品,可以通過簡單的靜脈注射進行輸注,無需進行配型或免疫抑制。在美國通過擴展訪問程序可用,此外還在新西蘭、瑞士等國獲得批準。
Prochymal于2009年首次在美國獲得批準,隨后被Osiris公司出售給澳大利亞的Mesoblast公司,并更名為Ryoncil。
2.Temcell
- 批準國家:日本
- 批準日期:2015年9月
- 細胞類型:骨髓間充質干細胞
- 適應癥:急性移植物抗宿主病(GvHD)
- 價格:868,680日元(約合7,700美元)/袋,一個標準療程通常需要8袋,因此總費用約合12.3萬美元)到18.5萬美元。
- 銷量:2024年10月30日財報顯示,當季銷售15億日元(約950萬美元)
- 概況:Temcell是由Mesoblast公司開發,日本JCR制藥公司銷售。Temcell在臨床試驗中顯示出良好的療效,特別是在治療類固醇難治性急性移植物抗宿主病方面。根據臨床數據,接受Temcell治療的患者在28天后的總體反應率達到56%。
其前身是Prochymal,由Mesoblast公司推動上市。此外,Temcell還被納入日本國民健康保險體系,這使得患者在治療時可以享受部分費用報銷,從而降低了實際支付負擔。

3.Ryoncil
- 批準國家:美國
- 批準日期:2024年12月18日
- 細胞類型:骨髓間充質干細胞
- 適應癥:用于治療2個月及以上兒童的類固醇難治性急性移植物抗宿主病(SR-aGVHD)。
- 價格:尚未公開
- 概況:這是FDA批準的首個間充質干細胞(MSC)療法。在一項多中心、單臂的III期臨床試驗中,70%的患者在接受Ryoncil治療28天后顯示出總體反應,這一指標與生存率相關。
由Mesoblast公司研發。Ryoncil作為一種創新的間充質干細胞治療產品,為類固醇難治性急性移植物抗宿主病患者提供了新的治療選擇,并在未來有望擴展到其他適應癥。

韓國產品
作為擁有最多間充質干細胞藥物的國家之一,韓國在過去10年內未有新產品獲批,而現有產品的市場表現也大相徑庭。
4.CellGram
- 批準國家:韓國
- 批準日期:2011年7月1日
- 細胞類型:自體骨髓間充質干細胞
- 適應癥:急性心肌梗死(AMI)
- 價格:1800萬韓元(約合15,000美元),且不在醫保報銷范圍內。
- 銷量:2018年,達到25億韓元的峰值,隨后開始下降,2023年為8億韓元。
- 概況:CellGram被認為是全球首個獲得批準的干細胞藥物,標志著干細胞治療領域的重要里程碑。在臨床試驗中,接受CellGram治療的患者在6個月后顯示左心室射血分數提高了約6%。
CellGram上市時需在6年內提供600名患者的臨床數據。Pharmicell后來申請將數量減至60人但被拒絕。這一情況引發了行業對其未來批準狀態的關注。2022年,CellGram被重新評估為先進生物制藥產品,表明其在監管政策下仍具備一定的發展潛力。

5.Cartistem
- 批準國家:韓國
- 批準日期:2012年1月
- 細胞類型:臍帶血間充質干細胞
- 適應癥:退行性關節炎和膝關節軟骨損傷
- 價格:1.9-2.1萬美元
- 銷量:累計給藥患者人數突破3.1萬,累計銷售額達到1080億韓元,2023年超過200億韓元(約1440萬美元)。
- 概況:Cartistem 是世界上第一個同種異體臍帶血干細胞療法,已證明其在抑制炎癥和再生受損軟骨組織方面的有效性。
Medipost正在準備Cartistem在日本和美國的3期臨床試驗,還計劃進入馬來西亞等東盟國家。在日本,滿足條件可以跳過1、2期臨床試驗,直接進入3期。

6.Cupistem
- 批準國家:韓國
- 批準日期:2012年1月
- 細胞類型:自體脂肪間充質干細胞
- 適應癥:克羅恩病的復雜性肛瘺
- 價格:約600萬韓元(約5000美元/次)
- 銷量:未公開
- 概況:Cupistem的一個顯著特點是其療效的持續性。在接受治療的患者中,81%在96周后仍保持愈合狀態。Cupistem于2014年獲得了韓國健康保險審查與評估服務(HIRA)的醫療保險價格批準,使得患者在經濟上能夠更容易接受該治療。
7.NeuroNATA-R
- 批準國家:韓國
- 批準日期:2014年7月30日
- 細胞類型:自體骨髓間充質干細胞
- 適應癥:肌萎縮側索硬化癥(ALS)和其他運動神經元病
- 價格:1.8萬至7.2萬美元
- 銷量:未公開
- 概況:NeuroNATA-R通過注射自體骨髓間充質干細胞,具有神經保護作用,可以延緩運動神經元的死亡,從而減緩ALS的進展。在評估安全性的I期臨床試驗中,共有7位患者接受了鞘內注射,隨訪12個月,結果顯示該治療方案具有良好的安全性。
印度產品
8.Stempeucel
- 批準國家:印度、歐盟
- 批準日期:2015年6月(在歐盟獲得孤兒藥地位)
- 細胞類型:骨髓間充質干細胞
- 適應癥:嚴重肢體缺血價格:2200美元(2017年)
- 銷量:未公開
- 概況:Stempeucel的研發歷時12年,采用獨特的池化技術(pooling technology),使得生產過程更高效,能夠為大量患者提供治療。臨床試驗表明,Stempeucel在改善嚴重肢體缺血患者的血流和功能方面具有顯著效果。
日本產品
9.Alofisel
- 批準國家:歐盟、日本
- 批準日期:2018年3月23日(在歐盟獲得批準),隨后在日本也獲得了批準。
- 細胞類型:脂肪間充質干細胞
- 適應癥:復雜性肛瘺
- 價格:562萬日元/劑(約3.6萬美元)
- 銷量:2020財政年度,Takeda從Alofisel獲得的收入約35萬美元。
- 概況:Alofisel在臨床試驗中顯示出良好的安全性,但最近的一項研究表明其效果與安慰劑相當,因此其臨床效益受到質疑。2024年12月,歐盟決定撤回Alofisel的市場授權,原因是未能提供足夠的數據以確認其療效。
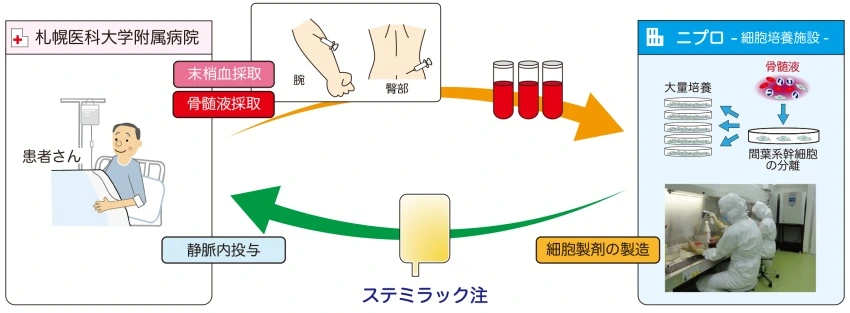
10.Stemirac
- 批準國家:日本
- 批準日期:2018年11月21日(獲得條件性和時間限制的批準)
- 細胞類型:骨髓間充質干細胞
- 適應癥:脊髓損傷相關的神經功能障礙
- 價格:約1500萬日元/劑(9.5萬美元)
- 銷量:據2019年的一篇文章預測,Stemirac將在未來9年中,每年給Nipro公司帶來約340萬美元的收入。
- 概況:Stemirac在日本獲得了條件性和時間限制的批準,允許其在市場上銷售,同時要求Nipro公司在七年內提供進一步的臨床數據以證明其有效性。Stemirac在臨床試驗中顯示出良好的安全性,被日本政府認定為突破性產品,旨在加速其上市過程,以便為急需治療的患者提供新的選擇。
11.AKUUGO
- 批準國家:日本
- 批準日期:2024年7月31日(獲得條件性和時間限制的批準)
- 細胞類型:骨髓間充質干細胞
- 適應癥:改善創傷性腦損傷(TBI)引起的慢性運動癱瘓
- 價格:尚未公開
- 銷量:尚未公開
- 概況:AKUUGO是一種同種異體間充質干細胞產品。它通過將人Notch-1胞內結構域基因暫時轉染到培養細胞中,增強了再生神經細胞的能力。研究結果表明,AKUUGO不僅具有神經保護作用,還能促進血管生成并發揮免疫調節功能。

伊朗產品
12.Mesestrocell
- 批準國家:伊朗
- 批準日期:2018年
- 細胞類型:骨髓間充質干細胞
- 適應癥:骨關節炎
- 價格:2億伊朗里亞爾(約4600美元)
13.StemSin
- 批準國家:伊朗
- 批準日期:2018年
- 細胞類型:骨髓間充質干細胞
- 適應癥:多發性硬化癥
- 價格:未公開
14.AlloStemSin
- 批準國家:伊朗
- 批準日期:2018年
- 細胞類型:臍帶間充質干細胞
- 適應癥:肌萎縮側索硬化癥
- 價格:未公開
15.Vartocell
- 批準國家:伊朗
- 批準日期:2020年
- 細胞類型:臍帶間充質干細胞
- 適應癥:腦癱
- 價格:1億伊朗里亞爾(每瓶含2000萬個細胞)約2300美元
中國產品
16.艾米邁托賽注射液
- 批準國家:中國
- 批準日期:2025年1月2日
- 細胞類型:臍帶間充質干細胞
- 適應癥:用于14歲以上患者的激素治療失敗的急性移植物抗宿主病(aGVHD),尤其是消化道受累為主的病例。
- 價格:尚未公開
- 概況:這是中國首款獲得批準的干細胞治療藥物,標志著國內干細胞藥物研發的重要里程碑。艾米邁托賽注射液通過利用人臍帶間充質干細胞修復受損組織和調節免疫功能,在臨床試驗中顯示出顯著的療效和安全性。
該藥物是通過中國國家藥監局的優先審評審批程序獲得上市的,意味著其在臨床上具有明顯的需求和潛在優勢。它將作為處方藥在醫院使用,為患者提供新的治療選擇。
展望未來
盡管目前間充質干細胞藥物的數量有限,但隨著科學研究的深入和技術的進步,預計未來將有更多基于MSC的產品進入市場,進一步擴大其臨床應用范圍。
同時,如何平衡藥物創新與患者負擔之間的關系,確保安全有效的細胞治療能夠惠及更廣泛的人群,將是行業內外共同面臨的挑戰。為了促進這一領域的健康發展,各國政府和監管機構也在不斷優化審批流程和支持政策,以加快優質產品的上市速度并降低患者的經濟門檻。
結論
綜上所述,全球已上市的16款間充質干細胞藥物不僅展示了細胞療法在治療多種難治性疾病方面的巨大潛力,也揭示了該領域存在的高成本問題。
隨著更多高質量隨機對照試驗結果的公布和技術的發展,我們期待看到更多性價比高的MSC藥物問世,從而更好地滿足未被滿足的醫療需求,為全球患者帶來福音。
信息來源:家干細胞
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信