阿爾茨海默病(Alzheimer’s Disease, AD)是一種以進行性認知功能衰退和行為異常為主要特征的神經退行性疾病,嚴重威脅著老年人的生活質量功能和社會。隨著全球人口老齡化的加劇,阿爾茨海默病的發病率逐年上升,給家庭和社會帶來了沉重的負擔。然而,傳統治療方法在延緩進展疾病和改善患者癥狀方面存在諸多局限,這促使醫學界不斷探索新的治療策略。
近年來,間充質干細胞(MSCs)作為一種具有多向分化潛能和免疫調節功能的細胞類型,逐漸成為AD治療研究的熱點領域。在間充質干細胞治療阿爾茨海默病的研究逐步深入的當下,深入探討其安全性問題顯得尤為重要。
間充質干細胞實驗室制備時,是通過什么方式來保證安全性的?
1.?細胞來源與制備的嚴格把控
在實驗室制備間充質干細胞時,為了確保其安全性,需要遵守一系列嚴格的規范和標準。
- 首先,所有操作需在符合GMP(良好生產規范)標準的潔凈用房內進行,所有操作都需事先制定標準操作規程(SOP),由經專業培訓的技術人員嚴格遵照執行,并進行記錄登記。
- 此外,實驗室或依托單位應對設備、儀器、試劑和耗材供應商進行資質審核認證,要求供應商提供產品質量報告和批次檢驗報告,并對試劑和耗材進行質量抽檢,避免采購質量不合格的產品。
- 所有與人間充質干細胞制備相關的設備和儀器正式使用前應做安裝確認、運行確認和性能確認,并定期進行第三方校準。
- 同時,GMP準則通過知情同意、捐獻者篩選以及嚴格的細胞分離和表征,確保只使用健康和優質的間充質干細胞(MSCs)。它降低了患者污染、傳染病傳播和意外免疫反應的可能性。
- 實施受控和可追溯的處理過程,確保間充質干細胞開發的每個階段,包括擴增、培養、冷凍保存和運輸,都有記錄、可驗證,并受嚴格的質量控制協議約束。
- 無菌生產環境提供嚴格的環境控制和無菌協議,確保間充質干細胞在跨境運輸過程中不受污染。
2.?免疫原性低
MSCs具有低免疫原性,移植后不易引發免疫排斥反應。研究表明,自體脂肪來源的MSCs在動物實驗中未引起免疫排斥反應或腫瘤發生。此外,MSCs來源的外泌體(MSC-Exo)免疫原性更低,且能穿越血腦屏障,為治療AD提供了更安全的選擇。
3.?旁分泌機制的利用
MSCs主要通過旁分泌作用發揮治療效果,而不是直接分化為神經元。它們可以分泌多種神經營養因子(如BDNF、NGF、IGF-1)和抗炎因子(如IL-10),這些因子能夠調節神經元突觸可塑性、抑制炎癥反應,并促進內源性神經再生。這種間接作用機制減少了細胞移植后的潛在風險。
本文將通過臨床案例來論述,間充質干細胞治療阿爾茨海默病的安全性到底如何。
從實驗室到臨床:間充質干細胞治療阿爾茨海默病的安全性保障
臨床案例:臍帶間充質干細胞治療后,24個月隨訪期間,沒有患者出現發燒等嚴重不良事件
2015年7月26日,韓國成均館大學醫學院三星醫療中心在國際期刊《Alzheimers Dement (N Y)》上發布了一篇《立體定向腦注射人臍帶血間充質干細胞治療阿爾茨海默病癡呆患者:1期臨床試驗》,主要評估立體定向腦注射人臍帶血間充質干細胞 (hUCB-MSC) 的安全性和劑量限制性毒性。

實驗設計:這是一項在三星醫療中心進行的開放標簽、單中心、 I 期臨床試驗。前三名 AD 癡呆患者接受了低劑量(總共3×106個細胞,海馬每側1×106個,右楔前葉1×106個)臍帶間充質干細胞。
在確認沒有嚴重不良事件后,我們選擇了另外六名 AD 癡呆患者通過相同途徑接受高劑量(總共 6.0 × 10 6 個 細胞,海馬每側2.0×106個,右楔前葉2 ×106個)臍帶間充質干細胞。本研究已獲得三星醫療 vCenter 機構審查委員會的批準
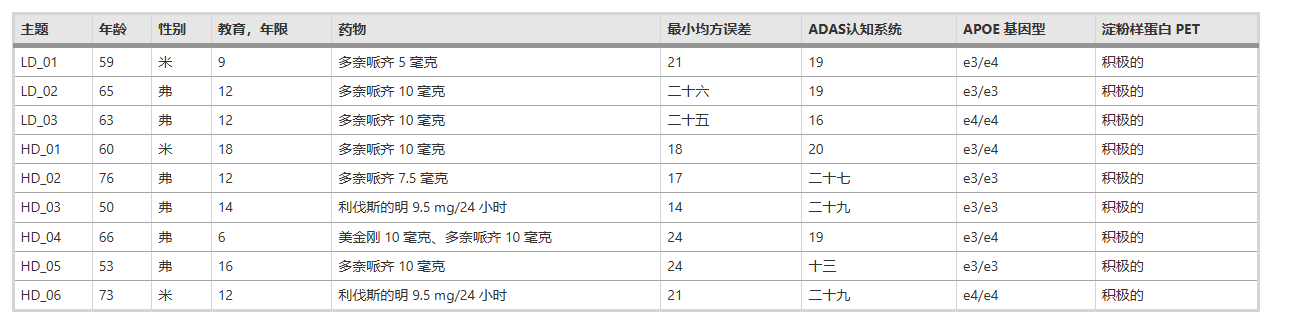
參與者的基線特征
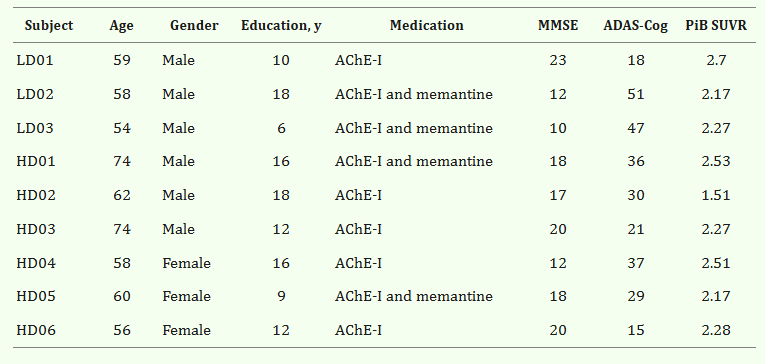
臍帶間充質干細胞的立體定向給藥
- (A)術中導航引導 hUCB-MSC 立體定向給藥。在縮回套管的同時,沿插入軌跡將 hUCB-MSC 注射到左右海馬和右楔前葉的四個部位(間隔 5 毫米)
- (B)然而,在九名患者中,有六名患者的第四次注射位于側腦室顳角,這可能是由于海馬嚴重萎縮所致。在這些情況下,省略的劑量被注射到右楔前葉,導致每個海馬有三個注射部位,右楔前葉有六個注射部位。
- (C)將 hUCB-MSC 立體定向注射到左海馬的示例
安全性評估:
所有入組患者均完成了為期 12 周的隨訪試驗;但在為期 24 個月的延長隨訪研究中,有一名患者因撤回同意而被排除在外。通過立體定位法注射 hUCB-MSC 在所有 9 名受試者中均安全完成。注射后 24 小時內進行的腦 CT 掃描證實任何患者均未出現腦出血。生命體征和體重穩定,任何患者均未出現發燒。
注射后 12 周和 24 個月進行的腦部 MRI 檢查證實,沒有出現包括腫瘤和硬膜下出血在內的結構異常。此外,無論是低劑量還是高劑量 hUCB-MSC 組,均未出現劑量限制性毒性。注射后 12 周和 12 個月進行的混合淋巴細胞反應結果表明,所有 9 名受試者的免疫學狀況均穩定。
結論:我們得出結論,將臍帶間充質干細胞立體定向注射到海馬和楔前葉是可行、安全且耐受性良好的。我們相信我們的研究為進一步的細胞療法研究鋪平了道路。
臨床案例:臍帶間充質干細治療阿爾茨海默病,沒有結構異常,所有受試者均未出現腦出血。
2021年9月14日,韓國首爾三星醫療中心在國際期刊《Alzheimer’s research and treatment》上發布了一篇《人臍帶血間充質干細胞腦室內注射治療阿爾茨海默病癡呆患者:I期臨床試驗》的研究結果,目的是評估三次重復腦室內注射人臍帶血衍生 MSCs (hUCB-MSCs) 的安全性和劑量限制性毒性。

實驗設計:這是一項開放標簽、單中心、 I 期臨床試驗,在韓國首爾三星醫療中心進行。首先,在局部麻醉下,參與者在右側腦室植入 Ommaya 儲液器,4 周后,參與者接受第一次 MSCs 注射,隨后每隔 4 周再注射兩次 hUCB-MSC。

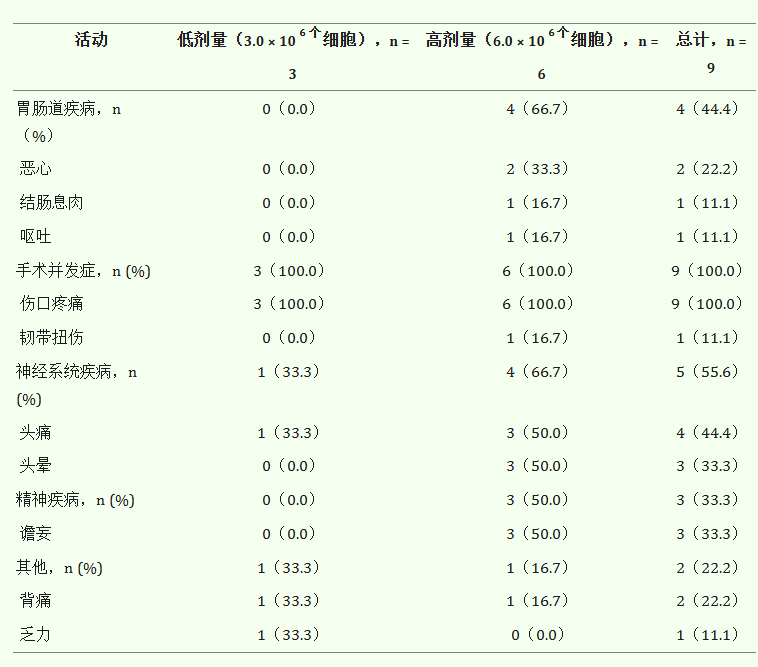
A:參與者以劑量遞增、開放標簽的方式接受三次重復 hUCB-MSC 注射,連續兩次注射(低劑量 [LD] 組為 1.0 × 10?7個細胞/2 mL,高劑量 [HD] 組為3×107個細胞/2 mL)。在繼續對后續參與者進行研究之前,我們確認沒有 DLT。空箭頭表示 hUCB-MSC 注射。
B:通過 Ommaya 儲液器向右腦室內注射 hUCB-MSC的示意圖
安全性評估:
參與者基線特征
9 名受試者對 Ommaya 儲液器置入手術的耐受性良好。然而,4 名受試者出現 Ommaya 置入部位疼痛或手術疼痛,1 名受試者出現頭痛。Ommaya 儲液器置入后 24 小時內進行的腦部 CT 掃描證實,所有受試者均未出現腦出血。
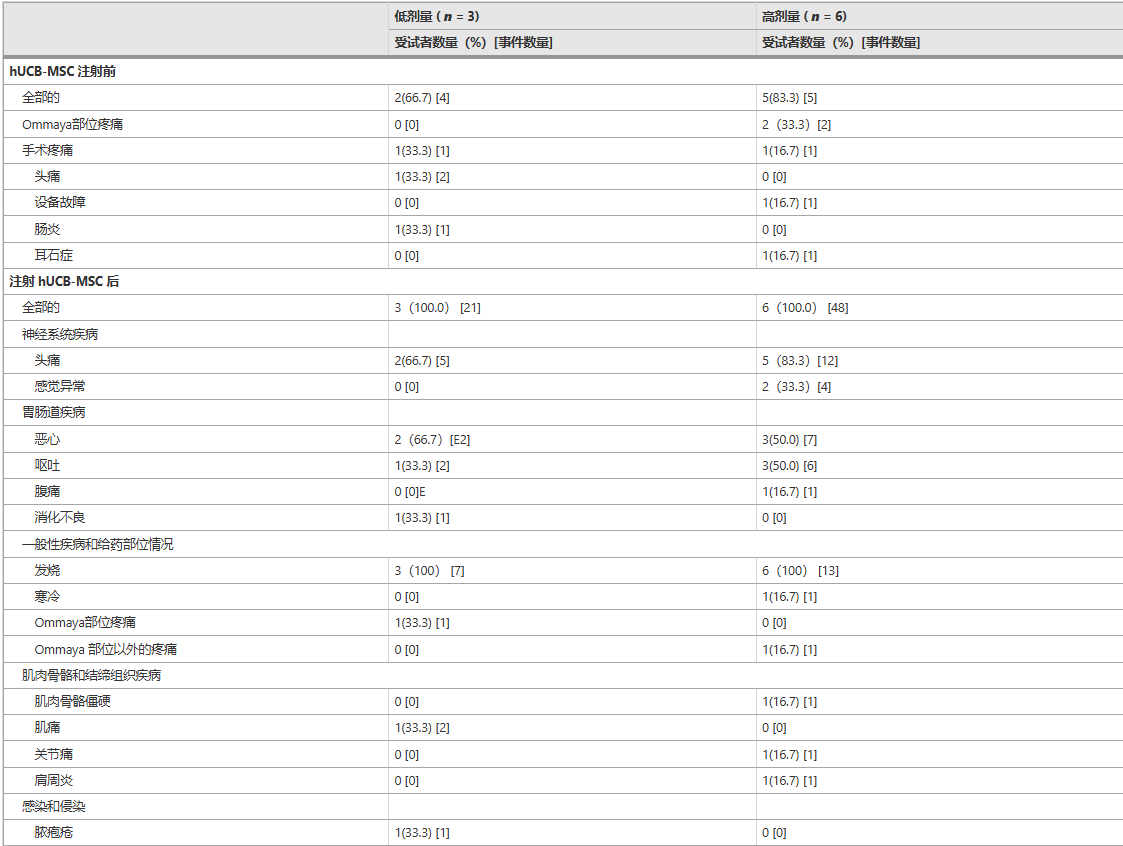

上述不良事件中,有2名受試者發生3次嚴重藥物不良反應。低劑量組(LD_01)的一名59歲男性在第二次hUCB-MSC注射后1天出現38.0°C發熱,住院時間延長一天進行密切觀察。第三次hUCB-MSC注射后1天,患者出現38.6°C高燒,住院時間再次延長一天。在兩次事件中,發熱均在第二天消退,無需使用抗生素或抗病毒藥物。
首次 hUCB-MSC 注射后 12 周以及延長觀察期間 12 個月和 24 個月拍攝的腦部 MRI 圖像證實,沒有結構異常,包括腫瘤、腦積水或硬膜下出血。此外,低劑量或高劑量 hUCB-MSC 組均未出現劑量限制性毒性。首次 hUCB-MSC 注射后 12 周進行的混合淋巴細胞反應結果表明,所有九名受試者的免疫學狀態均穩定。
結論:在本次 I 期臨床試驗中,我們通過 Ommaya 儲液器將 hUCB-MSC 反復注射到 9 名輕度至中度 AD 癡呆患者的右側腦室。我們報告稱,這種方法可行、安全且耐受性良好。
總結
綜上所述,臨床案例證實了間充質干細胞治療在其他疾病中的安全性,為阿爾茨海默病治療提供了有力的支持。盡管如此,我們仍需對間充質干細胞治療阿爾茨海默病的安全性進行持續的評估和監測。這包括對治療過程中可能出現的副作用、長期影響以及與其他治療方法的相互作用等方面的深入研究。通過不斷的臨床試驗和長期隨訪,我們可以更好地理解間充質干細胞治療的安全性,從而為患者提供更加安全、有效的治療方案。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。
版權說明:本文來自杭吉干細胞科技內容團隊,歡迎個人轉發至朋友圈,謝絕媒體或機構未經授權以任何形式轉載至其他平臺,轉載授權請在網站后臺下方留言獲取。



 掃碼添加微信
掃碼添加微信