神經(jīng)退行性疾病,如阿爾茨海默病、帕金森病和亨廷頓病等,以神經(jīng)元結(jié)構(gòu)與功能的漸進(jìn)性喪失為主要特征,常導(dǎo)致嚴(yán)重的致殘和死亡。當(dāng)前的治療手段大多僅能緩解癥狀,無法有效延緩或逆轉(zhuǎn)疾病進(jìn)程。在這一背景下,干細(xì)胞療法——尤其是間充質(zhì)干細(xì)胞(MSCs)及其衍生物——因其獨(dú)特的再生與免疫調(diào)節(jié)潛能,已成為治療神經(jīng)退行性疾病的研究熱點(diǎn)。
間充質(zhì)干細(xì)胞具有高度自我更新和多向分化能力,不僅可分化為神經(jīng)系細(xì)胞(如神經(jīng)元和膠質(zhì)細(xì)胞),還可通過旁分泌作用調(diào)節(jié)免疫反應(yīng)、減輕神經(jīng)炎癥,并分泌外泌體等活性物質(zhì)促進(jìn)神經(jīng)修復(fù)與功能重建。這些特性使MSCs成為神經(jīng)退行性疾病治療的理想候選者。然而,該領(lǐng)域仍面臨諸多挑戰(zhàn),包括優(yōu)化細(xì)胞遞送方式、提高移植細(xì)胞的長期存活與整合效率,以及深入闡明其治療作用的分子機(jī)制。
間充質(zhì)干細(xì)胞通過多機(jī)制途徑治療4大神經(jīng)退行性疾病的研究綜述
近日,新鄉(xiāng)醫(yī)學(xué)院醫(yī)學(xué)工程學(xué)院與河南省干細(xì)胞醫(yī)學(xué)國際聯(lián)合研究實(shí)驗(yàn)室合作在《World Journal of Stem Cells》發(fā)表綜述,系統(tǒng)探討了MSCs在神經(jīng)退行性疾病中的治療潛力。

該文章重點(diǎn)分析了此類疾病的流行病學(xué)特征、社會(huì)負(fù)擔(dān)及發(fā)病機(jī)制,并全面總結(jié)了MSCs如何通過調(diào)控異常蛋白聚集、神經(jīng)炎癥、氧化應(yīng)激及神經(jīng)變性等相關(guān)通路,從而延緩疾病進(jìn)展。
神經(jīng)退行性疾病的共同特征與流行病學(xué)負(fù)擔(dān)
神經(jīng)退行性疾病通常伴隨髓鞘損傷和突觸功能障礙,隨時(shí)間推移不斷惡化,最終導(dǎo)致認(rèn)知或運(yùn)動(dòng)功能嚴(yán)重喪失。
除常見疾病如阿爾茨海默病(AD)、帕金森病(PD)、亨廷頓病(HD)和肌萎縮側(cè)索硬化癥(ALS)外,尼曼匹克病C型(NPC)也屬于這一范疇。這類疾病與衰老密切相關(guān),隨著年齡增長,錯(cuò)誤折疊蛋白在大腦中累積,推動(dòng)疾病發(fā)生與發(fā)展(圖1)。
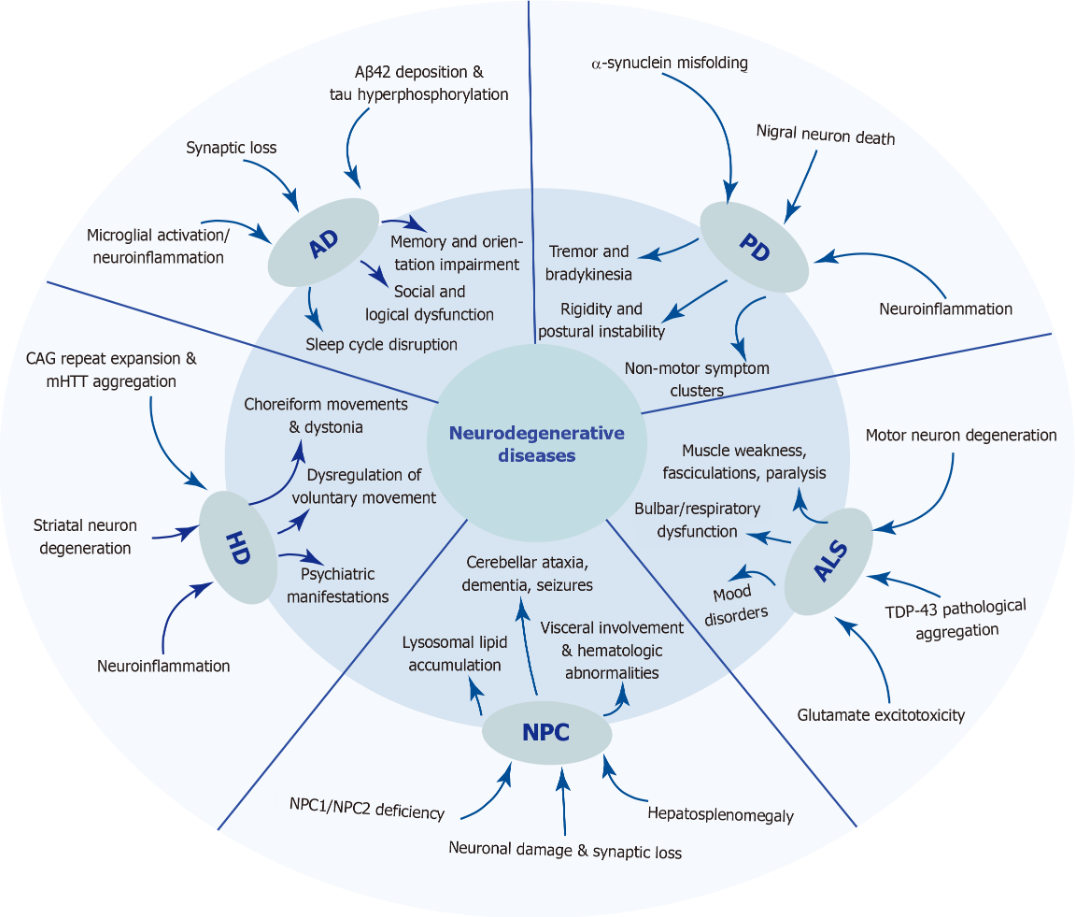
隨著全球老齡化加劇,神經(jīng)退行性疾病的發(fā)病率和患病率不斷攀升,不僅嚴(yán)重影響患者生活質(zhì)量,也帶來沉重的社會(huì)與經(jīng)濟(jì)負(fù)擔(dān)。
其病因復(fù)雜多樣,某些疾病如AD、HD和ALS與基因突變密切相關(guān),而不良生活方式也會(huì)增加發(fā)病風(fēng)險(xiǎn)。目前臨床干預(yù)以對(duì)癥藥物和非藥物治療為主,如生活方式調(diào)整、照護(hù)支持及康復(fù)訓(xùn)練,但仍缺乏可阻止疾病進(jìn)展的根本性治療手段。
當(dāng)前臨床治療策略及其局限性:現(xiàn)有藥物治療主要集中在癥狀緩解或有限程度的疾病修飾。例如,AD常用膽堿酯酶抑制劑、美金剛及抗Aβ單抗;PD以多巴胺能藥物及α-突觸核蛋白靶向治療為主;ALS僅三種藥物獲FDA批準(zhǔn),療效均有限;HD和NPC的治療選擇則更為稀缺。總體而言,尚無任何療法能夠逆轉(zhuǎn)神經(jīng)退行性病變。
干細(xì)胞療法憑借其自我更新和多向分化能力,為神經(jīng)退行性疾病的治療提供了新路徑。MSCs因來源廣泛、免疫原性低,兼具分化潛能和旁分泌功能,尤其受到關(guān)注。此外,干細(xì)胞衍生的細(xì)胞外囊泡(EVs)具有良好的生物相容性、低免疫風(fēng)險(xiǎn)及跨越血腦屏障的能力,可作為天然藥物遞送系統(tǒng),經(jīng)生物工程修飾后實(shí)現(xiàn)病灶精準(zhǔn)靶向,進(jìn)一步拓展了治療前景。
間充質(zhì)干細(xì)胞治療神經(jīng)退行性疾病的機(jī)制
MSCs的治療機(jī)制涉及幾個(gè)復(fù)雜且相互關(guān)聯(lián)的生物過程,包括歸巢、分化能力、旁分泌作用和神經(jīng)保護(hù)作用(圖2)。

間充質(zhì)干細(xì)胞 (MSC) 通過歸巢效應(yīng)遷移至損傷或炎癥部位。MSC具有多向分化潛能,可分化為中胚層和非中胚層譜系。此外,MSC通過分泌外泌體和生物活性分子促進(jìn)組織修復(fù)。此外,MSC還通過多種途徑發(fā)揮顯著的神經(jīng)保護(hù)作用。
1.歸巢作用:間充質(zhì)干細(xì)胞(MSCs)能夠通過表面分子與血管內(nèi)皮的相互作用實(shí)現(xiàn)“歸巢”,即遷移至受損組織。該過程包括滾動(dòng)、趨化因子識(shí)別、整合素激活、牢固黏附以及穿越血管內(nèi)皮,最終沿著趨化因子濃度梯度進(jìn)入病灶部位。到達(dá)病灶后,MSCs參與組織修復(fù)和免疫調(diào)節(jié),這是其發(fā)揮治療作用的第一步。
2.分化潛能:MSCs具備多向分化能力,除了成骨、成脂和成軟骨外,還能分化為肌細(xì)胞、心肌細(xì)胞、成纖維細(xì)胞、上皮細(xì)胞以及神經(jīng)元樣細(xì)胞。其分化方向受微環(huán)境條件影響,如生長因子刺激、氧濃度及培養(yǎng)條件等。通過優(yōu)化外部環(huán)境,可以提升MSCs向神經(jīng)系統(tǒng)相關(guān)細(xì)胞的分化效率,為神經(jīng)再生提供新的可能。
3.旁分泌效應(yīng):MSCs通過分泌細(xì)胞因子、生長因子及外泌體(Exos)來調(diào)節(jié)局部微環(huán)境,促進(jìn)損傷組織修復(fù)。越來越多證據(jù)表明,MSCs的主要治療效果并非依賴其存活和植入,而是通過旁分泌信號(hào)傳導(dǎo)實(shí)現(xiàn),包括抑制炎癥、促進(jìn)血管生成和神經(jīng)保護(hù)。外泌體因其可穿越血腦屏障、免疫原性低,被視為MSCs的無細(xì)胞替代方案,具有廣闊的應(yīng)用前景。
4.神經(jīng)保護(hù)作用:在神經(jīng)退行性疾病中,MSCs通過分泌TGF-β、IL-10等因子抑制炎癥反應(yīng),促進(jìn)小膠質(zhì)細(xì)胞向抗炎表型轉(zhuǎn)化,減少神經(jīng)元損傷。同時(shí),MSCs能通過分泌神經(jīng)營養(yǎng)因子、外泌體和microRNA,促進(jìn)軸突再生與突觸重塑,并通過電生理及代謝調(diào)節(jié)改善神經(jīng)元功能。這些作用共同構(gòu)成了MSCs在神經(jīng)退行性疾病治療中的神經(jīng)保護(hù)機(jī)制。
間充質(zhì)干細(xì)胞治療神經(jīng)退行性疾病的臨床前研究及臨床研究
MSCs分泌組(包括外泌體和胞外囊泡)具有與MSCs類似的免疫調(diào)節(jié)與再生修復(fù)功能,且因低免疫原性、無致瘤風(fēng)險(xiǎn)、便于儲(chǔ)存和投遞,顯示出更好的臨床轉(zhuǎn)化前景。目前已開展大量基礎(chǔ)與臨床研究,探索其在AD、PD、HD和ALS等疾病中的應(yīng)用。
間充質(zhì)干細(xì)胞及其衍生物在阿爾茨海默病治療中的應(yīng)用
近年來,MSC及其衍生物在治療AD方面的應(yīng)用取得了顯著進(jìn)展。大量基于不同動(dòng)物模型的臨床前研究一致證明了MSC及其衍生物的神經(jīng)保護(hù)潛力。這些作用包括減少Aβ沉積、調(diào)節(jié)神經(jīng)炎癥、促進(jìn)神經(jīng)再生,最終改善AD相關(guān)的認(rèn)知障礙。

1. 清除異常積累的蛋白質(zhì):干細(xì)胞治療阿爾茨海默病的主要機(jī)制之一是通過清除異常積累的蛋白質(zhì)來改善病理狀態(tài)。研究表明,多種間充質(zhì)干細(xì)胞(如骨髓、臍帶、脂肪來源的MSCs)及其衍生物(如外泌體)能夠顯著降低Aβ蛋白的沉積和tau蛋白的過度磷酸化。例如,靜脈注射MSCs可通過激活sirtuin-1信號(hào)通路抑制淀粉樣蛋白生成,而外泌體則通過調(diào)控PI3K/AKT/mTOR通路促進(jìn)Aβ的自噬降解,從而減輕認(rèn)知功能障礙。
2. 減少神經(jīng)炎癥:神經(jīng)炎癥和氧化應(yīng)激在AD進(jìn)程中發(fā)揮重要作用。MSCs及其衍生物能夠抑制小膠質(zhì)細(xì)胞的過度活化,降低促炎因子水平,緩解氧化應(yīng)激,并通過調(diào)控NLRP3炎癥小體等信號(hào)通路,重建受損的神經(jīng)微環(huán)境。這些作用有效減輕了神經(jīng)炎癥引起的損傷,從而改善認(rèn)知功能。
3. 促進(jìn)神經(jīng)發(fā)生:AD患者常伴隨神經(jīng)元持續(xù)丟失,導(dǎo)致認(rèn)知能力下降。MSCs和其外泌體能夠分泌腦源性神經(jīng)營養(yǎng)因子(BDNF)等活性物質(zhì),刺激內(nèi)源性神經(jīng)再生和突觸修復(fù),并通過PI3K/AKT/mTOR等信號(hào)通路減少神經(jīng)元凋亡。這些機(jī)制共同促進(jìn)神經(jīng)保護(hù)和功能恢復(fù),為神經(jīng)修復(fù)與再生提供了重要支持。
間充質(zhì)干細(xì)胞及其衍生物在治療帕金森病中的應(yīng)用
近年來,人們對(duì)探索MSC及其衍生物在帕金森病(PD)治療中的潛力興趣高漲。越來越多的證據(jù)表明,MSC通過多種機(jī)制發(fā)揮神經(jīng)保護(hù)作用,例如促進(jìn)多巴胺能神經(jīng)元存活、抑制神經(jīng)炎癥、減少α-SN聚集以及增加神經(jīng)營養(yǎng)因子的分泌。此外,不同來源的MSC在PD動(dòng)物模型中具有不同程度的治療效果。
1.清除α-突觸核蛋白(αSN)聚集:干細(xì)胞治療帕金森病(PD)的主要機(jī)制之一是減少α-突觸核蛋白(αSN)的異常聚集。研究表明,多種來源的間充質(zhì)干細(xì)胞(MSCs)及其衍生物,如外泌體,能夠有效降低大腦黑質(zhì)等關(guān)鍵區(qū)域的αSN水平。例如,將骨髓MSCs(BM-MSCs)注射到特定腦區(qū),或使用負(fù)載姜黃素的納米顆粒與外泌體結(jié)合后通過鼻內(nèi)給藥,均可顯著抑制αSN的聚集和毒性,從而改善PD模型動(dòng)物的運(yùn)動(dòng)功能障礙。
2.減少神經(jīng)炎癥反應(yīng):MSC及其衍生物通過抑制小膠質(zhì)細(xì)胞活化和下調(diào)炎癥通路(如NLRP3炎癥小體),能夠顯著減輕PD中的神經(jīng)炎癥。hUC-MSC外泌體鼻內(nèi)給藥可逆轉(zhuǎn)MPTP誘導(dǎo)的神經(jīng)元死亡,同時(shí)降低炎癥反應(yīng)。不同來源的MSC(如BM-MSCs、ADSCs、MenSCs)及其分泌產(chǎn)物也能通過多種機(jī)制減輕神經(jīng)炎癥,從而保護(hù)多巴胺能神經(jīng)元。
3.修復(fù)和再生多巴胺能神經(jīng)元:干細(xì)胞治療的核心目標(biāo)是修復(fù)和再生多巴胺能神經(jīng)元。hUC-MSCs等干細(xì)胞可以通過被誘導(dǎo)分化為多巴胺能神經(jīng)元,或通過其分泌的外泌體上調(diào)Wnt/β-catenin等神經(jīng)營養(yǎng)信號(hào)通路,來直接增加多巴胺的水平和神經(jīng)元的存活率。此外,移植牙髓干細(xì)胞(DPSCs)或負(fù)載腦源性神經(jīng)營養(yǎng)因子(BDNF)的細(xì)胞與外泌體,也被證實(shí)能有效修復(fù)神經(jīng)元丟失、改善動(dòng)物的旋轉(zhuǎn)行為等運(yùn)動(dòng)缺陷,促進(jìn)神經(jīng)功能的恢復(fù)。
間充質(zhì)干細(xì)胞及其衍生物在治療亨廷頓氏病中的應(yīng)用
亨廷頓氏病 (HD) 是一種進(jìn)行性神經(jīng)退行性疾病,主要特征是紋狀體神經(jīng)元的丟失以及運(yùn)動(dòng)和認(rèn)知功能障礙的出現(xiàn)。新興證據(jù)表明,MSC可能通過多種機(jī)制緩解HD的病理特征,包括減少突變型HTT蛋白的聚集、調(diào)節(jié)突觸可塑性、抑制神經(jīng)炎癥以及提供神經(jīng)營養(yǎng)支持。
改善神經(jīng)炎癥:干細(xì)胞治療亨廷頓氏病的主要機(jī)制之一是通過改善神經(jīng)炎癥來緩解疾病進(jìn)展。突變HTT蛋白會(huì)激活小膠質(zhì)細(xì)胞并引發(fā)神經(jīng)炎癥。研究表明,人足月胎盤羊膜MSC的條件培養(yǎng)基以及經(jīng)鼻給藥的BM-MSCs,都能有效調(diào)節(jié)小膠質(zhì)細(xì)胞的活性,抑制炎癥因子的釋放,從而改善R6/2模型小鼠的神經(jīng)功能障礙和多巴胺能信號(hào)傳導(dǎo),并提高其存活率。
神經(jīng)保護(hù)作用:另一核心機(jī)制是提供神經(jīng)保護(hù)作用,以對(duì)抗紋狀體神經(jīng)元的損傷和萎縮。干細(xì)胞及其衍生物通過多種信號(hào)通路發(fā)揮保護(hù)效應(yīng),例如靜脈注射BM-MSCs聯(lián)合樂卡地平可調(diào)控Ca2+/CaN/NFATc4和Wnt/β-catenin通路,增加腦源性神經(jīng)營養(yǎng)因子(BDNF)的表達(dá),從而抑制神經(jīng)毒性。同樣,將hUC-MSCs或其條件培養(yǎng)基移植至紋狀體,或靜脈注射DPSCs,都能恢復(fù)BDNF水平,改善運(yùn)動(dòng)功能障礙,有效保護(hù)神經(jīng)元。
間充質(zhì)干細(xì)胞及其衍生物在治療肌萎縮側(cè)索硬化癥中的應(yīng)用
MSCs及其衍生物在治療ALS方面顯示出顯著的神經(jīng)保護(hù)和抗炎潛力。ALS的病理生理特征是運(yùn)動(dòng)神經(jīng)元退化、神經(jīng)炎癥和谷氨酸興奮性毒性。目前的研究表明,MSCs可能通過多種機(jī)制減緩神經(jīng)系統(tǒng)疾病進(jìn)展。包括神經(jīng)營養(yǎng)因子的分泌、神經(jīng)微環(huán)境的免疫調(diào)節(jié)以及氧化應(yīng)激的降低。
減少神經(jīng)炎癥:干細(xì)胞治療肌萎縮側(cè)索硬化癥(ALS)的主要機(jī)制之一是減少神經(jīng)炎癥。ALS患者和小鼠模型中的小膠質(zhì)細(xì)胞會(huì)高度活化,釋放促炎因子和活性氧(ROS),加劇運(yùn)動(dòng)神經(jīng)元損傷。研究表明,靜脈注射人臍帶間充質(zhì)干細(xì)胞(hUC-MSC)的條件培養(yǎng)基或脂肪來源干細(xì)胞(ADSC)可通過將小膠質(zhì)細(xì)胞極化為抗炎表型、降低促炎細(xì)胞因子水平來抑制神經(jīng)炎癥。
此外,干細(xì)胞還能通過CX3CL1/CX3CR1信號(hào)軸和激活紅系核因子2 相關(guān)因子等途徑調(diào)控免疫微環(huán)境,從而改善腦脊液中的炎癥標(biāo)志物,且在臨床應(yīng)用中顯示出良好的安全性。
延長生存期與促進(jìn)神經(jīng)元存活:干細(xì)胞治療可通過抗氧化、抗凋亡和神經(jīng)保護(hù)作用延長ALS患者或模型動(dòng)物的壽命。hUC-MSC條件培養(yǎng)基可激活Nrf2/HO-1軸發(fā)揮抗氧化作用,聯(lián)合人參皂苷Rg1還可抑制 NF-κB/Bcl-2信號(hào)通路減少運(yùn)動(dòng)神經(jīng)元凋亡。臨床與動(dòng)物實(shí)驗(yàn)均顯示,干細(xì)胞療法能夠提高運(yùn)動(dòng)神經(jīng)元存活率,改善運(yùn)動(dòng)功能,并具有良好的耐受性和安全性。
聯(lián)合給藥與外泌體介導(dǎo)的神經(jīng)保護(hù):干細(xì)胞的聯(lián)合給藥方式(如腰椎穿刺與肌肉注射)可增強(qiáng)治療效果,促進(jìn)運(yùn)動(dòng)神經(jīng)元存活并改善運(yùn)動(dòng)能力。干細(xì)胞衍生外泌體(EVs)能夠逆轉(zhuǎn)ALS星形膠質(zhì)細(xì)胞對(duì)運(yùn)動(dòng)神經(jīng)元的毒性,改善神經(jīng)元微環(huán)境,并通過重復(fù)給藥顯著延長生存期、保護(hù)運(yùn)動(dòng)功能。此外,人誘導(dǎo)多能干細(xì)胞(iPSC)衍生EV的鼻內(nèi)給藥也顯示出改善運(yùn)動(dòng)能力和延長生存期的潛力。
臨床試驗(yàn):2025年6月,一項(xiàng)國際干細(xì)胞Ⅲ期臨床研究公布了令人矚目的新成果,為漸凍癥(ALS)治療帶來了新的曙光。研究團(tuán)隊(duì)對(duì)不同病程的患者進(jìn)行了分層分析,結(jié)果顯示:在“進(jìn)展緩慢型”患者這一亞組中,干細(xì)胞療法展現(xiàn)出顯著的療效信號(hào)。此外,該療法已在超過400例商業(yè)應(yīng)用和190例臨床試驗(yàn)中實(shí)施,未出現(xiàn)任何與治療相關(guān)的嚴(yán)重不良事件,安全性表現(xiàn)令人安心。

更值得關(guān)注的是,該療法顯著降低了神經(jīng)絲輕鏈(NfL)這一神經(jīng)退行性疾病的核心生物標(biāo)志物。NfL已被FDA視為加速審批的重要參考指標(biāo),正是基于該標(biāo)志物的變化,此前Tofersen療法得以率先獲批。
結(jié)論與展望
間充質(zhì)干細(xì)胞及其衍生物在治療神經(jīng)退行性疾病中表現(xiàn)出廣闊前景。它們不僅能夠通過多機(jī)制緩解疾病核心病理特征,還具備良好的安全性。尤其在旁分泌機(jī)制中扮演關(guān)鍵角色的外泌體、分泌組和細(xì)胞外囊泡,已成為無細(xì)胞治療策略的研究重點(diǎn)。
盡管在細(xì)胞來源、遞送方式、長期安全性及標(biāo)準(zhǔn)化生產(chǎn)方面仍存在挑戰(zhàn),但隨著基因編輯、生物工程和給藥技術(shù)的不斷創(chuàng)新,基于MSCs的治療方案有望逐漸走向臨床,為神經(jīng)退行性疾病患者提供新的希望。
總之,MSCs在神經(jīng)退行性疾病治療中展現(xiàn)出顯著前景。隨著研究的深入和技術(shù)的發(fā)展,基于MSCs的療法有望成為臨床可行的治療選擇。
參考資料:
[1]:Citation: Cui CX, Shao XN, Li YY, Qiao L, Lin JT, Guan LH. Therapeutic potential of mesenchymal stem cells in neurodegenerative diseases. World J Stem Cells 2025; 17(8): 107717 URL: https://www.wjgnet.com/1948-0210/full/v17/i8/107717.htm
DOI: https://dx.doi.org/10.4252/wjsc.v17.i8.107717
免責(zé)說明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請(qǐng)隨時(shí)聯(lián)系我。



 掃碼添加微信
掃碼添加微信