在過去的幾十年中,以細胞為基礎的再生醫學得到了快速發展。細胞療法已經顯示出越來越多的進展,許多細胞產品基于自體外周血淋巴細胞、同種異體或自體間充質基質細胞 (MSC)、造血細胞、成纖維細胞、軟骨細胞等。
什么是間充質干細胞?間充質干細胞的副作用和危害有哪些?
什么是間充質干細胞
間充質干細胞被認為是易于衍生的,并且是其他細胞來源中最適用的選擇,適用于廣泛的病理學。這些細胞通常取自骨髓、脂肪組織、臍帶、牙髓、牙齦、圍產期組織等。低分化MSC的細胞譜通常表現為CD73、CD105和CD90細胞表面標志物陽性,而造血標志物CD19、CD20、CD34和CD45呈陰性。MSCs分泌多種生長因子和細胞因子,這也決定了它們的再生效果。特別是,源自人臍帶的MSC釋放角質形成細胞生長因子 (KGF) 、肝細胞生長因子 (HGF) 、轉化生長因子-β (TGF-β) 和外泌體,從而抑制炎癥并導致受影響組織的血管形成和上皮形成改善。
間充質干細胞相關研究的激增創造了一種“包治百病”的范式,趨勢是將間充質干細胞用于治療各種疾病:白血病、貧血、自身免疫性疾病、退行性和心血管疾病以及惡性腫瘤。
最近,間充質干細胞的細胞療法甚至被用于治療2019冠狀病毒病 (COVID-19) 。然而,新的臨床試驗顯著增加了間充質干細胞治療的不良事件和副作用的報告。在某些情況下,細胞療法的有效性似乎被高估了,這可能會導致患者結局發生悲劇性后果。
我們旨在概述間充質干細胞的副作用和危害。其中一些是由于這種細胞的性質而發生的,而另一些可能與MSCs-細胞培養條件有關(圖1)。因此,我們正在提高對報告的不良事件和副作用的臨床和科學意識。
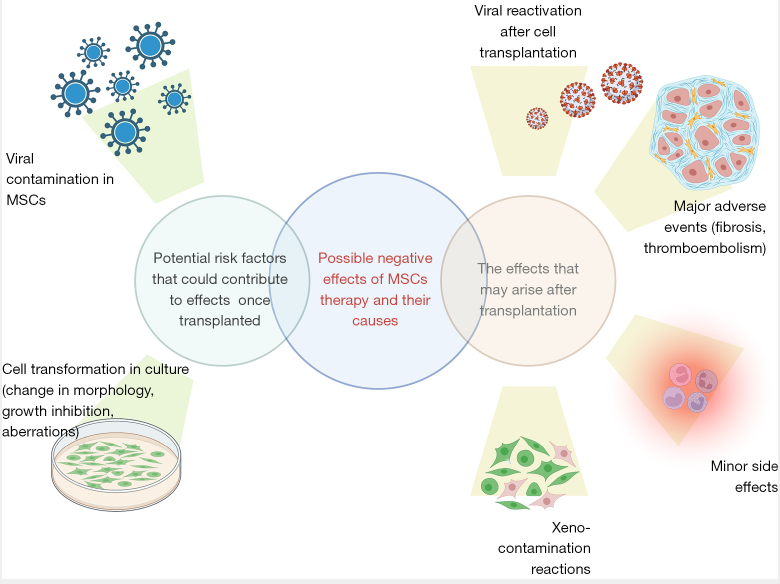
間充質干細胞的副作用和危害有哪些呢?
細胞注射后的主要不良事件:血栓栓塞和纖維化
大量報告的不良事件問題必須受到相當大的批判性關注。其中一些可以解釋為疾病進展的結果,盡管提供的細胞療法治療效果不充分。因此,視力喪失是三名年齡相關性黃斑變性患者對脂肪來源的MSC治療的負面反應。在另一項研究中,單獨使用MSCs治療不會導致局部給藥后潰瘍皮膚的全層恢復。
脂肪和骨髓來源的間充質干細胞治療側肌萎縮性硬化癥中的有效性也存在爭議。
例如,Syková等人進行的一項臨床試驗表明在應用骨髓來源的MSC后6個月內,僅某些患者的疾病進展減緩。另一項臨床試驗未顯示脂肪來源的MSC治療后有任何積極效果。這提出了MSCs對組織修復的實際臨床意義。此外,在一小群患者中接受COVID-19治療后,MSCs在12%的病例中引起了副作用。
間充質干細胞治療COVID-19的安全性和有效性因間充質干細胞引發的已知凝血作用而受到批評。
特別是MSCs可以通過釋放促凝血組織因子促進血栓栓塞。
一般來說,報告的不良事件還包括肝功能障礙、心力衰竭和過敏性皮疹,這些都是嚴重肺炎的典型并發癥。
吳等報道了輸注臍帶間充質干細胞后腎移植患者和慢性腎病患者發生炎癥相關血栓栓塞的兩例。重要的是,細胞療法的過量使用更有可能導致腎臟的腎小球和腎小管損傷。MSCs療法也可能導致肺栓塞。重要的是,血栓栓塞的風險以及細胞療法的有效性已被證明是由受體病史和表型特征決定的。
然而,我們必須將這些病例與以下主要不良事件區分開來,這些不良事件是由于MSCs的分化可控性較弱而出現的。最近,在一名慢性腎病患者輸注自體脂肪來源的MSC后觀察到間質組織纖維化和腎小管萎縮。重要的是,隨著纖維組織的發育,MSC分化成肌成纖維細胞的能力已經在之前的實驗研究中得到充分證明。
在這項多中心研究中,有2,372名接受自體間充質干細胞注射治療的退行性關節病患者入組。大多數不良事件只是術后疼痛或所治療疾病的并發癥。
眾所周知,間充質干細胞對免疫反應的抑制作用解釋了間充質干細胞治療移植物抗宿主反應和其他各種自身免疫性疾病的成功。隨后,間充質干細胞的全身給藥由于其免疫抑制特性導致了嚴重的不良事件。特別是,間充質干細胞療法會增加同種異體造血干細胞 (HSC) 移植后肺炎相關死亡的風險。此外,干細胞移植還與不同淋巴細胞群(CD4+T 輔助細胞、CD8+T細胞、CD19+和CD20+B淋巴細胞)的改變有關。CD4/CD8比率以及CD19+和CD20對干細胞療法有反應的患者+細胞數量減少。
干細胞注射后的輕微副作用:發燒和局部疼痛
大多數臨床研究報告說,使用間充質干細胞是安全可行的,只有輕微的副作用。
最常見的例子是在輸注hUC-MSC治療COVID-19后,22%的患者出現發熱,在hUC-MSC治療克羅恩病后,9.8%的患者出現發熱 (80 ),85%的患者出現發熱自體BM-MSC治療后患有進行性多發性硬化癥的患者。在5-24周的隨訪期間,使用同種異體間充質干細胞治療肝衰竭導致19.2%的患者出現發熱。發燒的原因之一被認為是對殘留的磷酸鹽緩沖鹽水 (PBS) 緩沖液的反應。對血管內注射MSCs的前瞻性臨床試驗的薈萃分析確定了MSCs與短暫發熱之間的顯著關聯。關節內注射MSC輕度積液并在48-72小時內增加患者的局部疼痛。
間充質干細胞療法對腫瘤的影響
腫瘤病史仍然是臨床研究的一個眾所周知的排除標準,原因是MSCs對腫瘤生長和行為的有爭議的影響。然而,一些出版物表明間充質干細胞給藥對腫瘤沒有影響,甚至抑制其在體內的生長。
我們認為進行全面的患者檢查以發現可能的惡性腫瘤并在開始基于細胞的治療之前排除患者至關重要。然而,重要的是要了解有100多種癌癥相關疾病,并且腫瘤診斷仍然是一項復雜的任務,并不總是能在早期階段識別出腫瘤,這會帶來一定的風險并限制基于細胞的療法。出于安全考慮,我們有理由建議目前,在可能的獲益大于風險的情況下,應謹慎行事基于細胞的療法(表1)。
表格1:間充質基質細胞治療的不良事件、副作用和并發癥
| 不良事件和副作用 | 成因 | 啟示 | 參考資料 |
|---|---|---|---|
| 培養中的細胞轉化(形態變化、生長抑制、畸變) | 長期培養(10代以上) 細胞培養基的誘變成分 具有特定抗原呈遞的培養細胞分化 | 注射細胞的全身免疫原性反應 局部炎癥和長期免疫反應 | ( 27-40 ) |
| MSC中的病毒遏制 | 使用受污染的培養物 進行冷凍儲存 在細胞處理和培養過程中違反生物安全規程 | 細胞功能障礙 病毒感染 注射后感染并發癥 | ( 41 – 49 ) |
| 異種污染反應 | 培養基中的外源生長因子 使用含有動物血清的細胞培養基 | 急性炎癥 | ( 50 – 62 ) |
| 細胞注射后的主要不良事件:血栓栓塞和纖維化 | 細胞聚集體注射 個人表型特征 個人敏感性 | 肺和腎血栓栓塞 心臟和肝纖維化 | ( 10 , 23 , 63-78 ) |
| 細胞注射后的輕微副作用 | 注射液中含有PBS緩沖液的殘留物;關節內注射 | 發熱; 局部疼痛 | ( 79 – 84 ) |
| 對腫瘤和贅生物的影響 | 促血管生成因子的表達;免疫抑制 | 惡性腫瘤的形成 | ( 85 – 90 ) |
如何降低間充質干細胞療法在移植過程中帶來的危害
多能細胞治療后的治療效果和并發癥發生率仍然值得懷疑。治療效果通常基于注射細胞旁分泌活動延長引起的抗炎作用。因此,應特別注意捐贈者的年齡。老年患者捐贈的MSCs改變了免疫調節特性。從患有動脈粥樣硬化的老年供體獲得的脂肪來源的MSC具有較高水平的促炎細胞因子IL-6和IL-8。
多種并發癥可以通過導致其遷移和粘附的間充質表型來解釋。與多能細胞不同,使用高度分化的體細胞仍然是無害的。因此,我們認為高度分化的細胞可能是再生醫學中的“黃金標準”。
報告的主要不良事件通常是由于對干細胞治療相關風險因素的認識不當造成的。根據觀察到的臨床報告,我們設計了一個簡短的清單,建議在所有MSCs移植病例中接受(表2)。
表2:細胞治療計劃的推薦清單
| 每次間充質干細胞移植前檢查是否: |
| 捐獻者的病歷不包含任何傳染病的信息 |
| 間充質干細胞低于9代 |
| 對支原體和皰疹病毒進行了PCR檢測 |
| 冷凍杜瓦瓶不含未經測試(即支原體和HHV-6)或未知細胞探針 |
| 調整細胞數量和濃度,不超過必要的治療限度 |
| 根據預期的細胞歸巢選擇全身遞送方式 |
| 抗組胺藥和抗炎藥已備好,無禁忌癥 |
另一種有效的替代方法是非培養細胞,在收獲后立即冷凍保存。
討論
大多數關于間充質干細胞的臨床研究只納入了有限數量的患者,這可能會影響統計顯著性的評估(圖2)。報告的主要不良事件可能與低分化細胞(即MSC)的系統性血管內給藥有關。進行的研究的重要部分是將MSC與生物材料和生物分子結合使用,這掩蓋了細胞的治療效果。另一個因素可能是在細胞療法的規劃中缺乏預測方法和定量方法。

結論
我們的簡短審查旨在評估低分化細胞干細胞療法的安全性。我們觀察到許多與無法控制的細胞分化和轉化相關的不良事件。我們發現在低分化和多能細胞的情況下,干細胞療法的安全性和可行性估計仍然很弱。
目前,臨床試驗的特權應針對最少操作和高分化的細胞。盡管有許多積極的報道,但間充質干細胞療法仍然是一種具有延遲不良反應的危險療法。它們的表現通常取決于制造質量和患者個體表型。臨床試驗的規劃和管理應考慮可能的并發癥,并強制包含在患者的知情同意書中。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信