帕金森病是一種由黑質多巴胺能神經元退化引起的神經退行性疾病。目前尚無治愈方法,因此迫切需要新的治療方法。一種正在研究的潛在策略是基于干細胞的方法來替換丟失的神經元,例如利用內源性神經干細胞 (NSC)。這些細胞位于與側腦室對齊的腦室下區 (SVZ),在老年和患病的哺乳動物大腦中處于休眠狀態。然而,在適當的刺激下,NSC可以轉變為活化狀態,增殖和分化。
從靜息到激活:靶向腦室下區的神經干細胞實現帕金森病原位神經再生
近日,知名醫學網站《Stem Cell Reports》上刊發了一項有關“腦室下區的神經干細胞:修復帕金森病大腦的潛在干細胞庫”的研究綜述。

在本綜述中,我們討論了帕金森病病理如何影響神經干細胞的行為,以及目前促進帕金森病再生的藥理學策略。SVZ的NSC可以作為腦修復的干細胞來源,未來的研究應該能夠闡明這些干細胞是否有可能產生功能性神經元細胞。
帕金森病:流行病學、病理機制與治療挑戰的三重維度
流行病學特征與病因:帕金森病(PD)是第二大常見神經退行性疾病,也是增速最快的神經系統疾病。2023年全球患者達850萬人,預計到2040年將增至1290萬。約85%-90%病例為散發性,僅10%-15%與家族遺傳相關。已發現多個基因突變可導致單基因型PD或增加患病風險,其他風險因素包括衰老、農藥等環境暴露。
病理機制與臨床表現:該病以運動癥狀(震顫、運動遲緩、肌強直)和非運動癥狀(認知障礙、睡眠障礙、抑郁)為臨床特征(圖1)。
核心病理改變是黑質致密部A9多巴胺能神經元丟失,導致紋狀體多巴胺耗竭,以及α-突觸核蛋白(aSyn)聚集形成的路易小體。病理aSyn最初被認為從腦干迷走神經背核和前嗅核擴散至全腦,但其累積程度與癥狀并非完全對應,提示存在共病理機制。非運動癥狀涉及膽堿能、腎上腺素能等多系統神經遞質缺損。
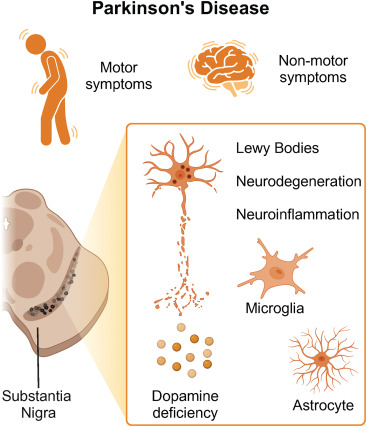
治療現狀與未來方向:現有療法無法阻斷疾病進展。左旋多巴替代治療可緩解運動癥狀,深部腦刺激術可調節基底節功能,抗抑郁藥等輔助治療能改善生活質量。干細胞療法通過替換丟失神經元,成為極具潛力的神經修復策略,亟待突破現有對癥治療的局限。
鑒于現有療法的局限性,基于干細胞的神經再生策略成為突破方向,主要包括三大路徑:移植替代、內源性激活與神經再生調控。
干細胞治療帕金森病的三維路徑:移植替代、內源性激活與神經再生
01、移植療法的演進與突破
帕金森病(PD)因特定腦區神經元選擇性丟失的特征,長期被視為細胞替代療法的理想靶點。1989年首次將人胎兒干細胞(FSCs)經立體定位注射移植至患者紋狀體,實現臨床癥狀初步改善,該研究奠定了移植治療的概念驗證基礎。
近十年研究拓展至胚胎干細胞(ESCs)和誘導多能干細胞(iPSCs)等多種來源,其中自體iPSC技術突破倫理限制并規避免疫排斥,推動多巴胺能細胞替代療法進入新階段。
02、內源性修復的新范式
針對神經退行性疾病及腦損傷,激活內源性神經干細胞(NSCs)成為新興策略。成年哺乳動物腦內神經發生區持續存在NSCs,其在衰老/病變腦中仍具活性。但成年腦內NSCs多處于靜息狀態,需通過治療策略激活其增殖分化能力。
該途徑可同時修復多巴胺能、膽堿能及腎上腺素能系統,對改善PD運動/認知雙重障礙具有獨特價值。
03、神經再生機制的轉化前景
本綜述將系統探討:①成年腦神經再生的分子調控機制;②PD病理對NSCs行為的影響;③促進多巴胺能神經再生的藥理策略。
通過解析神經發生的內源調控網絡(如靜息態激活、定向分化等),為開發”喚醒”腦自修復能力的新型療法提供理論框架,最終推動PD神經再生治療的臨床轉化。
什么是成人SVZ中的神經干細胞:平衡靜止和激活?
成年哺乳動物腦內有兩個神經發生微環境:海馬齒狀回的顆粒下區和與側腦室對齊的腦室下區 (SVZ)。SVZ由神經干細胞、不同細胞譜系的祖細胞(即神經祖細胞[NPC]和少突膠質細胞祖細胞)、神經母細胞、微環境星形膠質細胞、小膠質細胞和少突膠質細胞組成(圖2)。
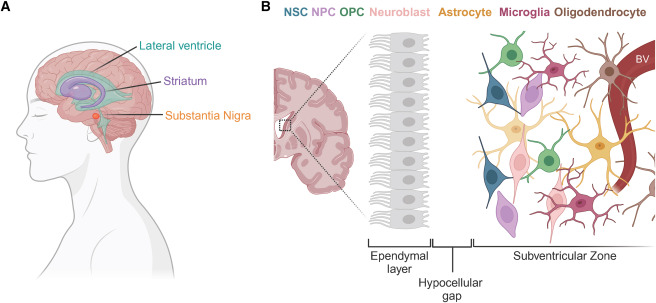
兩種狀態的定義與特征
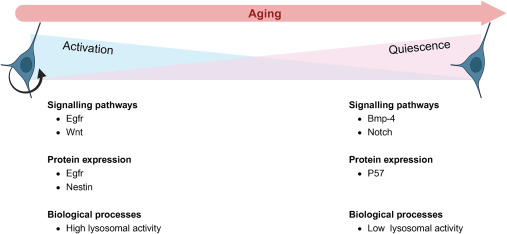
靜止NSC:靜止狀態的神經干細胞(NSC)是緩慢循環或近乎休眠的細胞,基本不進行分裂增殖。它們的關鍵特征包括缺乏增殖標志物、不表達表皮生長因子受體(Egfr)和Nestin蛋白。
靜止NSC的主要功能是作為“干細胞池”,長期維持成體神經干細胞庫,是神經發生的儲備力量。這種靜止狀態是可逆的,在特定信號刺激下能夠被重新激活。它們通常來源于胚胎發育時期的慢循環/靜止祖細胞群。
活化NSC:活化狀態的神經干細胞(NSC)則處于活躍增殖期。它們在體內具有神經源性,能夠直接產生后代細胞(如神經祖細胞、神經母細胞等),并在體外培養中能形成神經球。
活化NSC是神經發生過程中活躍的“生產者”。其神經發生輸出存在物種差異:在嚙齒動物中,活化NSC主要產生遷移至嗅球并整合入網絡的神經元;而在人類中,它們則產生遷移至紋狀體的少量鈣調蛋白中間神經元。
維持神經干細胞平衡的重要性:
維持干細胞庫:保持一部分NSC處于靜止狀態對于防止干細胞庫在穩態條件下因過度消耗而枯竭至關重要。這確保了神經發生能夠長期持續。
應對需求與損傷:靜止的NSC作為一個儲備池,可以在需要時(如損傷后、特定生理信號刺激下)被激活,補充活化的NSC群體,從而放大神經發生反應。有證據表明靜止 NSC 可能對環境信號(如損傷信號)更敏感。
適應衰老:隨著年齡增長,NSC傾向于更多地進入靜止狀態,導致神經發生減少。理解平衡機制是尋找促進老年大腦神經再生策略的關鍵。
調節神經干細胞平衡的兩大核心機制
神經干細胞內在調控機制 (細胞自主):
- 細胞周期調控因子:如細胞周期蛋白依賴性激酶抑制劑P57在維持靜止中起重要作用。
- Notch信號通路:Notch信號(尤其是其效應子如 Hey1)在胚胎祖細胞靜止的建立和維持中至關重要,成年期 Notch2/Notch3也被證明通過抑制細胞周期進程基因來促進靜止。
- 粘附分子:如Vcam1在胚胎期慢循環NSC中表達,對調節靜止期和維持出生后NSC庫大小很重要。
- 微RNA:如miR-17-92的表達增加會促進活化(增殖和神經發生)。
- 溶酶體活性:溶酶體活化是NSC退出靜止狀態所必需的。衰老時溶酶體活性降低,阻礙了重新激活的能力。增強溶酶體降解反而有助于維持靜止。
- 代謝狀態:靜止和活化NSC的代謝特征存在差異。
神經干細胞的外在調控機制 (微環境信號):
- Wnt信號通路:是關鍵的活化信號。其抑制劑Sfrp5在衰老NSC中增加,抑制Wnt通路導致靜止增加。激活Wnt通路可以促進靜止NSC的再激活和增殖。非經典Wnt信號下游的Cdc42也參與維持靜止。
- 骨形態發生蛋白 (BMP) 信號:Bmp-4信號誘導靜止狀態。
- 成纖維細胞生長因子 (FGF) 信號:Fgf-2與Bmp-4結合,可以誘導一種“啟動靜止”狀態,使NSC更容易被激活。處于此狀態的NSC高表達Lrig1,抑制Lrig1會促進增殖。
- 表皮生長因子受體 (EGFR) 信號:Egfr及其下游信號通路 (PI3K/Akt, Mek/Erk, mTOR) 是強有力的增殖/活化信號。
- 炎癥信號:衰老過程中炎癥信號增加與靜止狀態增加有關。
- 異質性:單細胞 RNA 測序揭示SVZ中NSC存在從靜止到活化的連續梯度狀態,反映了微環境信號和內在狀態的復雜性。
總結來說:成人SVZ中的神經干細胞通過精細調控的內在分子程序(如P57, Notch, Vcam1, 溶酶體活性, miRNA) 和外在微環境信號(如Wnt, BMP, FGF, EGFR, 炎癥因子) 在靜止(休眠儲備) 和激活(增殖分化) 狀態之間保持動態平衡。
這種平衡對于長期維持神經干細胞庫、保障終生神經發生的潛力、以及響應損傷和生理需求至關重要。隨著年齡增長或病理狀態,這種平衡會向靜止傾斜,導致神經發生減少。理解這些調控機制為未來開發促進神經再生和修復的策略提供了理論基礎。
帕金森病的神經發生
神經干細胞池的存留性與臨床啟示:為了能夠促進PD患者的神經發生,首先需要解決的問題是這個NSC池是否仍存在于患病的PD大腦中。
我們通過臨床研究表明:PD患者SVZ區NSCs數量與健康人無顯著差異,證實病變腦內仍保有神經再生潛力。但尸檢研究僅捕捉終末期狀態,需警惕時間動態差異:早期PD的NSCs行為可能完全不同。
核心未解問題是:現存NSCs池能否通過擴增補充足量多巴胺能神經元?
已證明PD的病理特征和多種遺傳因素會影響NSC的增殖和分化能力(圖4)。為了成功開發刺激神經發生的治療方法,需要確定病理和基因突變對NSC行為的影響。在下面的章節中,我們將討論目前關于多巴胺耗竭和基因突變如何影響神經干細胞行為的知識。
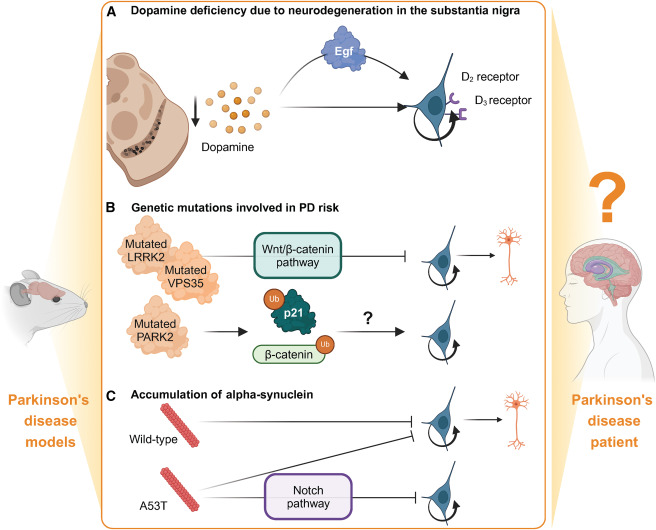
影響成人神經發生的帕金森病病理特征有哪些?
一、多巴胺能系統崩潰與神經微環境失衡
紋狀體多巴胺耗竭:黑質致密部A9多巴胺能神經元進行性丟失,導致紋狀體多巴胺嚴重不足。
多巴胺直接調控腦室下區(SVZ)神經干細胞(NSC)增殖:實驗表明,多巴胺D2受體激動劑可促進SVZ區NSC向神經元分化。
效應:PD患者多巴胺缺失顯著抑制SVZ神經發生,削弱神經元新生能力。
Wnt/β-catenin通路抑制:PD病理微環境中,Wnt抑制因子(如Sfrp5)累積,阻斷Wnt信號傳導。Wnt通路是NSC分化為多巴胺能神經元的關鍵驅動力;其抑制導致神經再生障礙。
證據:清除Sfrp5可重啟老年小鼠SVZ的NSC增殖。
二、α-突觸核蛋白病理與毒性擴散
路易小體形成與神經元功能障礙:病理性α-突觸核蛋白(aSyn)聚集成路易小體,直接損傷神經元及NSC微環境。
- aSyn異常聚集抑制線粒體功能,增加氧化應激,導致NSC凋亡。
跨腦區病理傳播:aSyn從腦干(迷走神經背核)向嗅球、海馬及皮質擴散(Braak分期),破壞神經發生關鍵區域。
臨床關聯:aSyn在嗅球早期累積解釋PD患者嗅覺減退,反映神經發生區首當其沖。
三、神經炎癥與膠質細胞異常活化
小膠質細胞/星形膠質細胞激活:病變腦區促炎因子(TNF-α、IL-1β)升高,激活NF-κB通路,直接抑制NSC增殖。反應性星形膠質細胞分泌BMP-4,誘導NSC靜息態,阻遏神經再生。
溶酶體-自噬系統衰竭:aSyn聚集物堵塞自噬流,導致異常蛋白累積,損害NSC自我更新。
衰老PD腦中溶酶體活性下降,進一步限制NSC退出靜息態。
促進帕金森病神經發生的方法
嚙齒動物模型已證明,如果得到適當的刺激,靜止的NSC可以重新激活。例如,與野生型小鼠相比,MPTP小鼠模型的黑質中BrdU+和Th+細胞有所增加。
因此,進一步研究可用于增強SVZ NSC再生能力的不同方法非常重要,包括使用多巴胺激動劑、小分子、生長因子和脂質。
在下一節中,我們將討論正在研究的不同方法在嚙齒動物PD模型中重新激活NSC和刺激SVZ中神經發生的效果(圖5)。
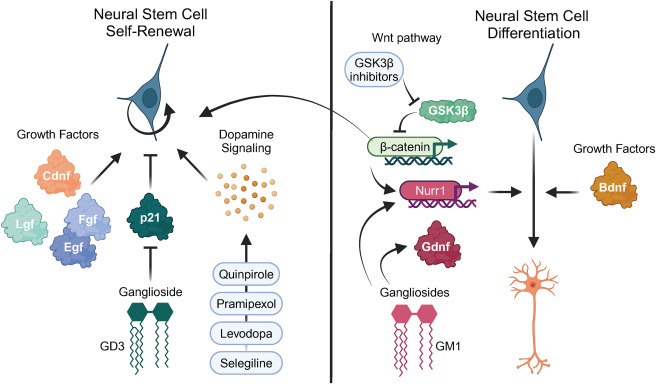
一、藥物干預:靶向神經再生通路
1、多巴胺受體激動劑促進神經干細胞自我更新
多巴胺能藥物(如左旋多巴、普拉克索)除緩解PD運動癥狀外,可激活神經干細胞增殖:小鼠模型證實其挽救6-OHDA損傷側的NSC自我更新能力。
局限性:僅促進嗅球神經元分化,難修復紋狀體。
2、經典Wnt通路的激活促進神經發生
如前所述,Wnt/β-連環蛋白通路在調控成人神經發生中起關鍵作用,其通路成員可作為促進神經再生的治療靶點。PD嚙齒類模型及患者腦中活化型Gsk-3β水平升高,提示Wnt通路活性受抑。Marchetti實驗室研究表明:激活Wnt/β-catenin通路可增強SVZ神經發生。
關鍵藥物:
| 抑制劑 | 效應 | 模型 |
|---|---|---|
| AR-AO14418 | 增加黑質多巴胺能神經元,恢復紋狀體Dat功能 | MPTP小鼠 |
| SB216763 | 促進新生神經元向紋狀體遷移 | 6-OHDA小鼠 |
優勢:突破嗅球局限,實現多巴胺缺失區修復。
二、生長因子與脂質調控
1、生長因子促進神經干細胞自我更新或分化
生長因子(含神經營養因子)對發育期大腦神經干細胞(NSC)的自我更新與分化至關重要。成年腦室下區(SVZ)中,生態位星形膠質細胞可提供生長因子,NSCs亦接觸富含生長因子的腦脊液。在嚙齒類PD模型中的研究表明:
BDNF干預:遺傳性多巴胺神經退變小鼠(Girk2突變)中,腹腔注射BNN-20(P14-P60)提升腦源性神經營養因子(Bdnf)濃度,使黑質BrdU+/Th+細胞增加,但SVZ的Pcna+細胞未變。P45腦室注射DiI示蹤證實新生多巴胺能神經元源自SVZ,表明BDNF特異性促進NSC分化而非增殖。
多因子效應:腦室灌注表皮生長因子(Egf)、成纖維細胞生長因子2(Fgf-2)、肝生長因子(Lgf)或腦多巴胺神經營養因子,可增加6-OHDA大鼠SVZ分裂細胞。部分研究觀察到這些BrdU+細胞同時表達Dcx(未成熟神經元標志),并向鄰近紋狀體遷移。
未解問題:需明確Dcx+細胞能否在紋狀體成熟為功能性神經元并改善PD運動癥狀。
2、神經節苷脂促進神經干細胞自我更新
病理關聯與核心保護機制:神經節苷脂(尤其GM1)缺失是PD重要病理特征,其保護作用通過雙重通路實現:
- 抗α-突觸核蛋白毒性:GM1抑制aSyn病理性聚集,增強GDNF信號通路;
- 維持干細胞穩態:GD3作為靜息態NSC池的”看門分子”,防止過度耗竭。臨床證據顯示PD患者腦內GM1水平顯著下降,提示其可作為疾病進展的生物標志物。
鼻腔給藥研究揭示兩類神經節苷脂的互補功能:
- GD3靶向增殖:激活SVZ區NSC自我更新(BrdU+/Sox2+↑),但無法驅動神經元成熟(嗅球Th+無增加);
- GM1靶向分化:通過核轉錄因子Nurr1直接調控Th基因表達,生成功能性多巴胺能神經元。
GD3與GM1互補:
| 類型 | 給藥方式 | 功能 | 機制 |
|---|---|---|---|
| GD3 | 鼻給藥 | 激活SVZ-NSC增殖 | 抑制p21細胞周期抑制劑 |
| GM1 | 鼻給藥 | 生成功能性多巴胺能神經元 | 激活Nurr1調控Th表達 |
突破方向:GD3→GM1序貫治療或可同時實現”擴增NSC池”與”定向分化為多巴胺能神經元”,為神經再生療法提供新范式。
三、外源性神經干細胞移植
神經干細胞移植作為促進帕金森病神經發生的關鍵策略,通過直接補充丟失的多巴胺能神經元實現功能修復。其核心突破在于:
- 細胞來源革新——誘導多能干細胞(iPSCs)經重編程技術規避倫理限制,分化為中腦多巴胺能神經元(A9亞型),移植后存活率超70%。
- 精準分化控制——激活Wnt通路誘導轉錄因子LMX1A表達,確保神經元具運動調控功能(與嗅球神經元區分);
- 結構功能重建——移植5個月后,人源神經元與宿主紋狀體中型棘神經元形成功能性突觸,改善運動癥狀。
- 現存挑戰:移植神經元可能受宿主α-突觸核蛋白病理侵襲出現路易小體,需聯合抗病理策略(如α-syn清除)形成“細胞替代-病理阻斷”雙軌療法以實現長期療效。
未來方向
有證據支持內源性NSCs和多能干細胞衍生神經元的再生潛力。這兩種干細胞都是值得研究的干細胞來源,因為細胞移植是治療局部損傷的可行方法。例如老年癡呆癥的黑質。然而,對于阿爾茨海默病等神經元缺失更為彌漫的疾病,甚至是大腦皮層乙酰膽堿能神經元缺失的帕金森病,神經元移植是不夠的。
因此,我們應該對這兩種方法進行投資,以確保開發出一種更加個性化的方法,使局部和彌漫性腦損傷后的人腦再生。
內源性神經干細胞的臨床轉化瓶頸:為了使內源性神經干細胞 (NSC) 成為促進腦再生的有效干細胞來源,我們需要確定休眠NSC被重新激活的程度、它們產生不同類型神經元(包括多巴胺能神經元)的能力,以及它們完全整合到局部神經網絡的能力。
事實上,未來的研究需要評估來自腦室下區 (SVZ) 的NSC能否產生正確亞型的功能性多巴胺能神經元(例如,黑質多巴胺能神經元或嗅球多巴胺能神經元),這些神經元能否整合到局部神經網絡并長期存活。
人腦NSCs認知局限與技術突破:成人與衰老人腦室下區(SVZ)神經干細胞(NSCs)的研究受限于人腦組織稀缺及離體研究的技術壁壘。
然而新技術正以空前分辨率解析人NSCs:大型聯合項目已繪制新生兒、嬰幼兒、成人及衰老腦的NSCs圖譜,揭示其分子指紋與神經發生潛能。人腦單細胞圖譜的興起進一步解析神經元亞型網絡,理解這種多樣性對再生療法至關重要。
人腦移植研究的突破與警示:人胎中腦組織成功移植至帕金森病患者黑質或紋狀體后,隨訪3-24年證實移植多巴胺能神經元長期存活并重建神經支配。但部分移植神經元出現路易小體病理,伴隨臨床癥狀復發,這強調需同步抑制病理進程與促進神經再生。
這些發現顛覆認知:證明衰老/病變腦仍具顯著可塑性,其機制雖未明確,但為內源性神經干細胞(NSCs)修復提供理論框架。新生神經元同樣發展出PD病理,警示單純神經元替代無法實現長期療效。
未來治療范式的根本轉變:因此,要成功治療帕金森病,需要采取一種多管齊下的方法,將刺激腦再生和改善病情的策略結合起來,以防止新的多巴胺能神經元發展為疾病病理,并阻止病情進展。
主要參考資料:
[1]https://www.cell.com/stem-cell-reports/fulltext/S2213-6711(25)00137-7
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信