最新研究表明,抗CD19嵌合抗原受體(CAR)T細胞療法已成為難治性自身免疫性疾病(AID)的重要治療選擇,在系統性紅斑狼瘡和系統性硬化癥中觀察到部分患者實現長期無藥物緩解,而在多發性硬化(MS)和類風濕關節炎(RA)領域亦有多項鼓舞性個案報道。
一名RA/MS患者經過CAR-T治療失敗后,經過自體干細胞移植后,主觀健康狀態顯著改善!
近期,國際著名期刊雜志“Annals of the Rheumatic Diseases”報道了一項“Relapse after anti-CD19 CAR T-cell therapy in a patient with severe rheumatoid arthritis and multiple sclerosis effectively treated by autologous stem cell transplantation”(一名嚴重類風濕性關節炎和多發性硬化癥患者接受抗CD19 CAR-T細胞治療后復發,經過自體干細胞移植后安全有效)的研究報道[1]。

自體造血干細胞移植(HSCT)用于重癥AID治療已逾20年,逐步發展為系統性硬化癥及MS的標準療法之一,但在RA中因傳統治療手段的顯著進步及HSCT療效證據不足,目前已不再常規應用。本病例首次詳述同一患者分別針對RA和MS序貫接受CAR-T細胞療法與HSCT的聯合治療策略。
病例簡述:該32歲女性患者(接受造血干細胞移植時年齡)20歲確診復發緩解型多發性硬化(MS),因高疾病活動性先后接受β-1a干擾素與芬戈莫德治療。

2016年春季使用阿侖單抗(連續5日每日12mg)實現MS無病緩解,但2017年3月出現對稱性侵蝕性多關節炎,確診為血清陰性類風濕關節炎(RA),病程呈高度侵襲性且對多種治療耐藥(圖1A)。后續接受甲氨蝶呤、利妥昔單抗、阿巴西普、阿那白滯素、多種JAK抑制劑、托珠單抗、TNF抑制劑、環磷酰胺(6周期,750mg/m2)及司庫奇尤單抗治療均未獲得持續緩解。
因缺乏有效治療選擇,2023年5月啟動學術機構研發的CD19靶向CAR-T細胞治療。患者RA長期依賴大劑量糖皮質激素(GC),無需額外MS特異性治療。
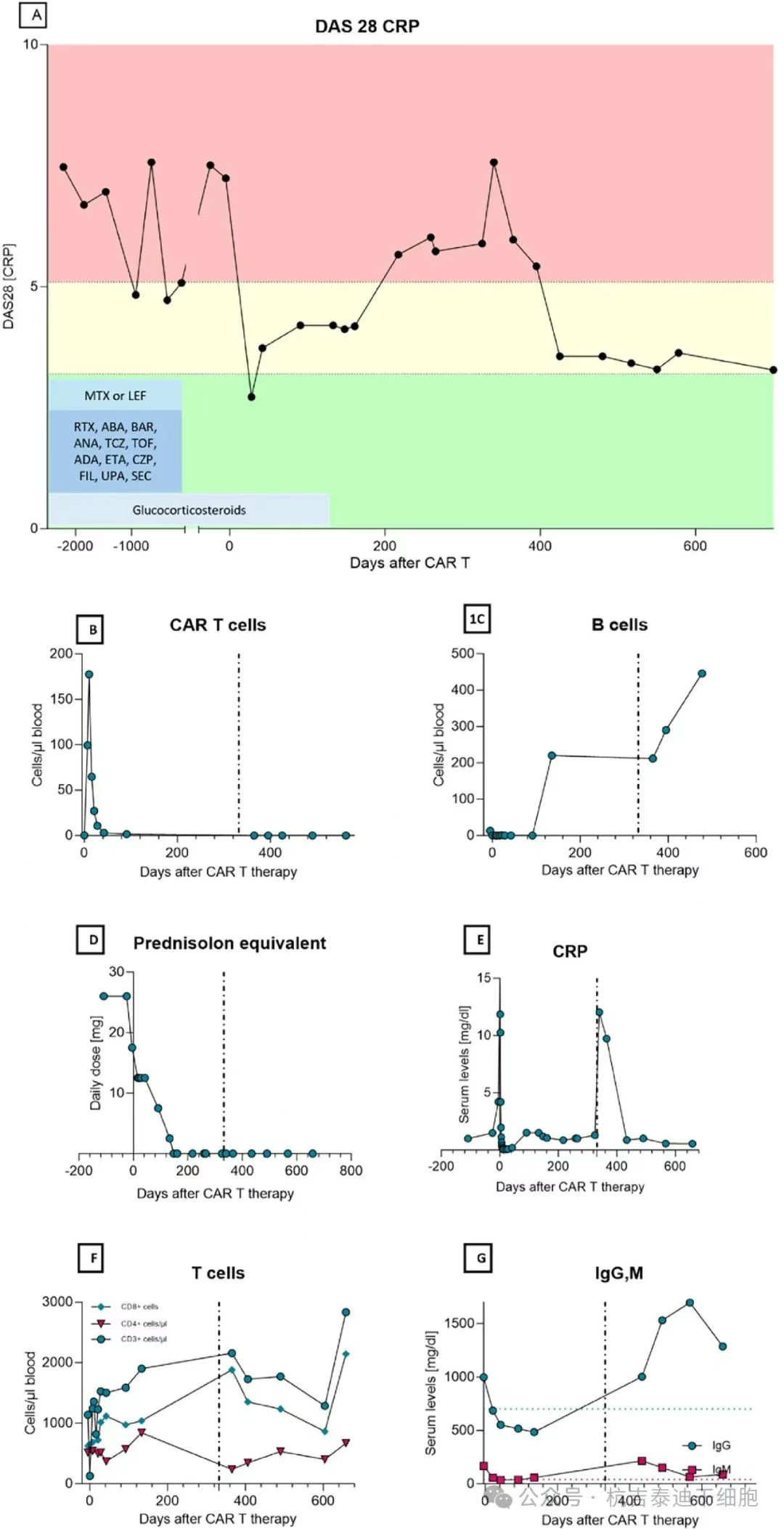
圖1:通過DAS28和依次給予的伴隨藥物測量的CAR-T細胞療法和HSCT在RA疾病活動性方面的結果 (A);CAR-T細胞擴增 (B)、B 細胞耗竭 (C)、繼續服用潑尼松劑量 (D)、CRP水平 (E)、T細胞亞群 (F) 和免疫球蛋白水平 (G)。黑線標記HSCT的時間點(CAR-T細胞治療后第332天)。
CAR-T治療過程:自體T細胞經白細胞分離術獲取,使用含CD3-zeta共刺激結構域的第二代CD19靶向CAR慢病毒載體(美天旎生物)進行新鮮轉導。預處理期間將GC減量并轉換為30mg氫化可的松。
2023年5月16日(第0天)在氟達拉濱+環磷酰胺(CYC)預處理后輸注CAR-T細胞(1.1×10?/kg)。CAR-T細胞擴增及B細胞耗竭符合預期(圖1B,C),未出現免疫效應細胞相關神經毒性綜合征(ICANs)或MS活動,僅第1-2天發生II級細胞因子釋放綜合征(經托珠單抗控制)。
患者第11天出院,逐步減停氫化可的松至第150天(圖1D)。治療后早期C反應蛋白(CRP)與疾病活動評分(DAS28)改善,第28天達臨床緩解,但8個月后滑膜炎嚴重復發(圖1A,E),此時B細胞數量已恢復正常數周(>200CD19+B細胞/μL)(圖1C)。
HSCT挽救治療:2024年4月行造血干細胞移植(HSCT),采用CYC+來格司亭動員,預處理方案為CYC(4×50mg/kg)聯合兔抗胸腺細胞球蛋白(Grafalon,總劑量23.5mg/kg),回輸CD34+篩選干細胞。移植前后未予免疫抑制治療。術后DAS28與CRP持續下降,患者主觀健康狀態顯著改善。但出現帶狀皰疹中樞神經系統感染(已預防用藥情況下)。HSCT后B細胞群未減少,而T細胞群顯著下降(圖1C,F)。
總結
據我們所知,這是首例報道在CAR-T細胞療法未能獲得持續緩解的B細胞驅動型自身免疫性疾病(AID)患者中,通過連續造血干細胞移植(HSCT)實現治療成功的案例。
尤其值得注意的是,該患者在阿侖單抗治療后出現的血清陰性多關節炎展現出非典型特征:盡管符合美國風濕病學會(ACR)和歐洲抗風濕病聯盟(EULAR)的類風濕關節炎(RA)分類標準,我們推測這種多重難治性癥狀可能是阿侖單抗誘導的繼發性自身免疫性關節炎。盡管已有研究證實阿侖單抗可誘發多種繼發性AID,但其引發關節炎的報道仍相對罕見。因此我們強調,抗CD19 CAR-T細胞療法對經典(血清陽性)RA仍具有重要治療價值。
在本案例中,造血干細胞移植實現的深度免疫清除比單純B細胞深度耗竭顯示出更顯著的療效。對于混合型及血清陰性AID患者,干細胞移植仍是極具潛力的治療選擇,應在必要時予以應用。
參考資料:[1]https://ard.eular.org/article/S0003-4967(25)00886-6/abstract
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信