在全球約1700萬腦癱(Cerebral Palsy, CP)患者中,超過80%因運動功能障礙、肌張力異常及認知損傷面臨終身依賴護理的困境。作為全球最常見的兒童致殘性神經發育障礙,腦癱的治療長期局限于康復訓練與藥物對癥處理,而無法修復受損的神經回路。在此背景下,干細胞療法憑借其獨特的神經再生與修復潛力,成為再生醫學領域最具突破性的探索方向。然而,盡管療效備受期待,安全性始終是臨床轉化的核心挑戰。
本文基于多項臨床試驗數據,系統分析干細胞治療腦癱患者的短期安全性表現及潛在風險。研究聚焦于治療后1-12個月內的不良事件(AEs),包括免疫反應、神經功能惡化、全身毒性等動態變化,全面評估治療風險。

干細胞治療腦癱的短期安全性:機制與臨床證據
一、干細胞治療腦癱的類型與治療機制
目前應用于腦癱治療的干細胞主要包括:
- 間充質干細胞(MSCs):來源于臍帶、骨髓或脂肪組織,具有免疫調節和旁分泌功能,可減輕神經炎癥、促進血管生成。
- 神經干細胞(NSCs):直接分化為神經元或膠質細胞,修復受損神經環路。
- 臍帶血單核細胞(UCB-MNCs):富含多種干細胞和生長因子,改善局部微環境。
這些細胞通過靜脈輸注、鞘內注射或局部靶向移植等途徑遞送,短期內以調節炎癥和減少繼發性損傷為主。
相關閱讀:腦癱治療選間充質還是神經干細胞?機制、療效和安全性的全面對比
二、常見短期不良反應類型
- 輸注相關反應:發熱、寒戰、頭痛(多與細胞制劑中的細胞因子釋放有關)。
- 局部不適:鞘內注射后腰痛或短暫下肢無力。
- 免疫相關風險:同種異體干細胞可能引發輕度免疫應答,但MSCs因低免疫原性,風險較低。
- 罕見事件:驚厥加重(個案報告,可能與基礎疾病波動相關)。
值得注意的是,目前尚無研究報道干細胞治療導致死亡或嚴重器官損傷的案例。
三、短期安全性臨床研究數據
3.1 神經干細胞治療腦癱患者的短期安全性
2013年,武警浙江總隊醫院兒科曾在國際期刊《Journal of Translational Medicine》上發表過一篇關于《來自自體骨髓間充質干細胞的神經干細胞樣細胞用于治療腦癱患者》的研究成果。共有60名腦癱患者參加了這項開放標簽、非隨機、觀察者盲法對照臨床研究,并進行了6個月的短期隨訪。

安全性結果:NSC治療后未立即發現新的神經功能缺損。本研究中的所有患者在治療后均接受了超過6個月的觀察。60名患者均未出現與實驗操作相關的發燒、頭痛、異常性疼痛、嘔吐或其他嚴重不良事件。
后續MRI評估未顯示任何可能提示不良事件的顯著解剖或結構變化。未發現任何新的缺血性、出血性或腫瘤性病變的證據。然而,一名患者報告哭鬧頻率增加,但在治療后2天自行緩解,無需任何干預。對照組和移植組還評估了其他可能的不良反應或并發癥,但兩組間新發疾病的發生率無差異。
3.2 臍帶間充質干細胞治療腦癱安全性
2021年,伊朗德黑蘭在行業期刊《干細胞研究與治療》上發表了一篇關于《腦癱患者臍帶組織間充質干細胞鞘內注射后的臨床和影像學結果:一項隨機雙盲假對照臨床試驗》的臨床試驗結果。
該研究納入72例腦癱患者,通過隨機雙盲假手術對照設計,對其接受臍帶源間充質干細胞鞘內注射治療的療效及安全性進行評估,隨訪周期為1至12個月。

安全性結果:本研究中,參與者共報告5起不良事件,均未達到嚴重不良事件(SAE)標準(CTCAE 3-5級)。具體如下:
UCT-MSC組:
- 發熱:2例(5.5%,2/36)患者在鞘內注射后24小時內出現低熱(38-38.7°C),無感染征象(如腦膜炎),癥狀自行緩解;
- 腰痛:8例(22.2%);
- 嘔吐:1例(2.8%);
- 其他癥狀:輕度至中度煩躁(6例)、頭痛(5例)。
對照組:輕度至中度煩躁(3例)、頭痛(1例)。
所有癥狀均發生于術后24小時內,且均為輕度至中度(CTCAE 1-2級),無需特殊干預即緩解。未觀察到感染相關并發癥(如腦膜炎)或嚴重不良事件(SAE)。研究表明,臍帶組織間充質干細胞鞘內注射治療腦癱患者是安全的,并且可以改善臨床和影像結果。
3.3 臍帶血單核細胞對痙攣性腦癱患者的安全性
2022年,伊朗德黑蘭科研人員在國際期刊《BMC神經病學》上發表了一篇關于《臍帶血單核細胞對痙攣性腦癱患者的安全性和有效性:一項隨機雙盲假對照臨床試驗》的臨床研究成果。

該研究納入72例痙攣性腦癱患者,隨機分為兩組(每組36例),通過干預前基線評估及干預后1、3、6、12個月的多次隨訪,系統評估臍帶血單核細胞治療的療效與安全性。
安全性結果:不良事件列于圖1中。在治療后24小時內接受UCB-MNC的17例患者中共觀察到30起不良事件。未報告嚴重事件,且在隨訪期間,患者或其父母均未報告任何不良事件,表明短期不良事件與腰椎穿刺有關。
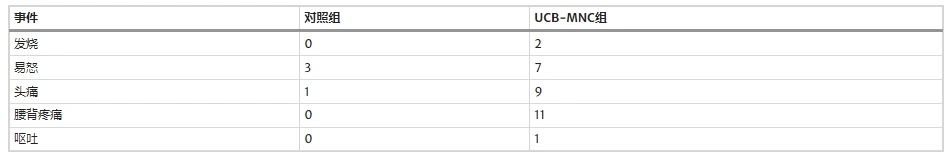
四、總體安全性總結
綜上所述,神經干細胞移植治療腦癱未觀察到治療相關神經功能損傷或影像學異常,僅1例出現短暫哭鬧增加;臍帶間充質干細胞鞘內注射治療腦癱的不良事件以輕度發熱、腰痛和短暫煩躁為主,均自行緩解;臍帶血單核細胞治療腦癱的不良事件完全由腰椎穿刺操作引起(如腰痛),且無長期風險。三類療法的不良事件均為輕度至中度(CTCAE 1-2級),且未發現與干細胞直接相關的感染、腫瘤或神經損傷,提示其短期安全性可靠,但需注意局部操作相關反應(如腰痛、短暫發熱)的管理。
這些研究為干細胞治療腦癱提供了關鍵安全性證據,支持其作為潛在治療手段的可行性。盡管不同療法的不良事件類型和發生率存在差異(如UCT-MSC組腰痛發生率較高,UCB-MNC組不良事件完全與操作相關),但均未影響患者長期預后,且安全性未隨隨訪時間延長而惡化。
五、影響安全性的關鍵因素
患者基線狀態:嚴重免疫功能低下或活動性感染患者需謹慎評估。
細胞來源與制備:標準化制備流程可減少污染和異常免疫反應風險。
給藥途徑:鞘內注射較靜脈輸注更易引起頭痛,但靶向性更高。
六、挑戰與未來方向
個體化治療方案:根據患者年齡、分型和干細胞類型優化劑量與頻次。
標準化安全性評估體系:需建立統一的短期不良反應監測標準。
長期隨訪數據補充:短期安全性良好不代表長期無害,需結合多年隨訪驗證。
結語
當前臨床試驗表明,干細胞治療腦癱在短期內具有良好的安全性,未出現嚴重免疫排斥或器官毒性,常見不良反應多為輕微且自限性。然而,需進一步通過大規模、多中心試驗完善安全性數據,并建立標準化操作流程以降低風險。未來,干細胞治療有望成為腦癱綜合治療的重要補充手段,但需持續關注長期療效與潛在風險。
相關閱讀:干細胞治療腦癱的長期安全性如何?4項臨床試驗深度解析
參考資料:
Chen, G., Wang, Y., Xu, Z. et al. Neural stem cell-like cells derived from autologous bone mesenchymal stem cells for the treatment of patients with cerebral palsy. J Transl Med 11, 21 (2013). https://doi.org/10.1186/1479-5876-11-21
Amanat, M., Majmaa, A., Zarrabi, M. et al. Clinical and imaging outcomes after intrathecal injection of umbilical cord tissue mesenchymal stem cells in cerebral palsy: a randomized double-blind sham-controlled clinical trial. Stem Cell Res Ther 12, 439 (2021). https://doi.org/10.1186/s13287-021-02513-4
Zarrabi, M., Akbari, M.G., Amanat, M. et al. The safety and efficacy of umbilical cord blood mononuclear cells in individuals with spastic cerebral palsy: a randomized double-blind sham-controlled clinical trial. BMC Neurol 22, 123 (2022). https://doi.org/10.1186/s12883-022-02636-y
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信