糖尿病(Diabetes Mellitus, DM)作為全球增長最快的代謝性疾病之一,已導致超過4.25億患者陷入長期血糖失控與多系統并發癥的困境。盡管胰島素替代療法和新型降糖藥物(如GLP-1受體激動劑)在血糖管理中取得進展,但其無法逆轉胰島β細胞進行性損傷,亦難以阻止糖尿病腎病、視網膜病變及心血管疾病等致命并發癥的惡化。
近年來,干細胞療法因其組織再生與免疫調節的雙重潛力,被視為突破糖尿病治療瓶頸的革新策略。其中,人類羊膜上皮干細胞(hAESCs)憑借其獨特的生物學特性,正成為該領域的研究焦點。
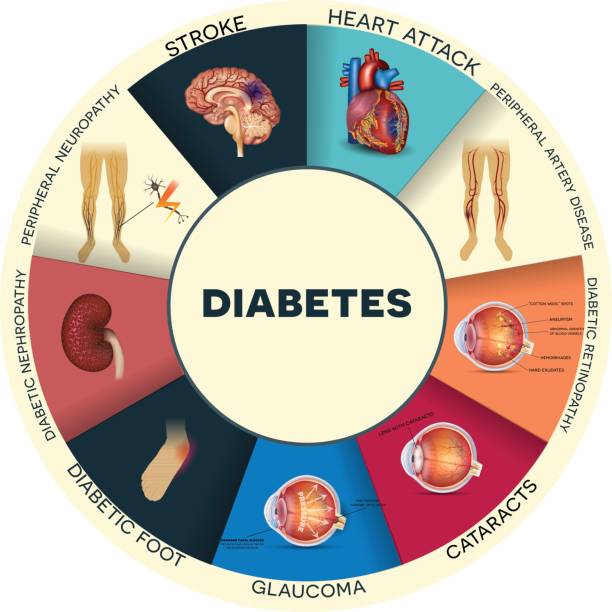
人類羊膜干細胞是治療糖尿病及其8大類并發癥的潛在方法
近日,南昌大學江西醫學院在《Human Cell》期刊雜志發表了一篇“人類羊膜上皮干細胞是治療糖尿病及其相關并發癥的潛在方法”的文獻綜述。

該綜述將批判性地審查人類羊膜上皮干細胞在治療糖尿病及其并發癥方面的新興研究進展和潛在應用價值。
首先,我們將討論人類羊膜上皮干細胞的特點、來源和分化為胰島素分泌細胞的優勢。
隨后,我們將重點介紹人類羊膜上皮干細胞在治療糖尿病并發癥(例如糖尿病視網膜病變、糖尿病腎病和糖尿病神經病變等)中的潛在應用。我們將仔細研究涉及人類羊膜上皮干細胞治療的相關臨床研究和試驗的進展。
總之,作為一種新興的糖尿病治療方法,人類羊膜上皮干細胞具有巨大的潛力和應用價值。盡管在實際應用中面臨諸多挑戰,但我們相信,隨著科學進步和技術進步,人類羊膜上皮干細胞將在治療糖尿病及其相關并發癥方面發揮關鍵作用。
糖尿病治療的迫切需求與干細胞療法的崛起
糖尿病病理核心在于胰島β細胞功能衰竭或胰島素抵抗。傳統胰島移植雖能部分恢復胰島素分泌,卻受限于供體短缺與免疫排斥風險。
間充質干細胞(MSCs)的臨床研究(如骨髓與臍帶來源MSCs)雖在動物模型中展現出修復胰島微環境、調控Th17/Treg平衡及促進血管新生的能力,但其功能異質性、體內存活率低及致瘤風險仍制約臨床轉化。相較之下,hAESCs因其胚胎源性低免疫原性、多向分化潛能及豐富的旁分泌因子庫,展現出更優的臨床應用前景。
相較于胚胎干細胞的局限性,羊膜干細胞的優勢
胚胎干細胞(ESCs)在細胞治療中用于修復組織損傷,同時加深了我們對疾病進展和機制的理解。特定疾病細胞系可輔助藥物開發。盡管干細胞領域取得顯著進展,但胚胎干細胞相關的倫理問題、致瘤性及免疫排斥等問題限制了其實際應用。目前針對這些障礙的研究正在推進,有望革新疾病管理。從圍產期組織中分離的干細胞因易獲取性和低免疫原性,成為再生醫學和細胞治療的潛在候選。
hAESCs的獨特優勢
hAESCs源自胎盤羊膜上皮層,兼具胚胎干細胞的多能性與成體干細胞的穩定性。其核心優勢包括:
低免疫原性:不表達HLA-II類分子且低水平表達HLA-I,可規避同種異體移植排斥反應;
強抗炎與促修復能力:通過分泌TSG-6、IL-10等因子抑制NF-κB通路,減輕胰島炎癥損傷,同時分泌VEGF與HGF促進血管生成與組織修復;
定向分化潛能:在特定誘導條件下可分化為胰島素分泌細胞(IPCs),并形成功能性胰島樣結構。
近期研究進一步揭示,hAESCs可通過線粒體轉移修復受損β細胞功能,并通過調控巨噬細胞M2極化改善糖尿病腎病纖維化。
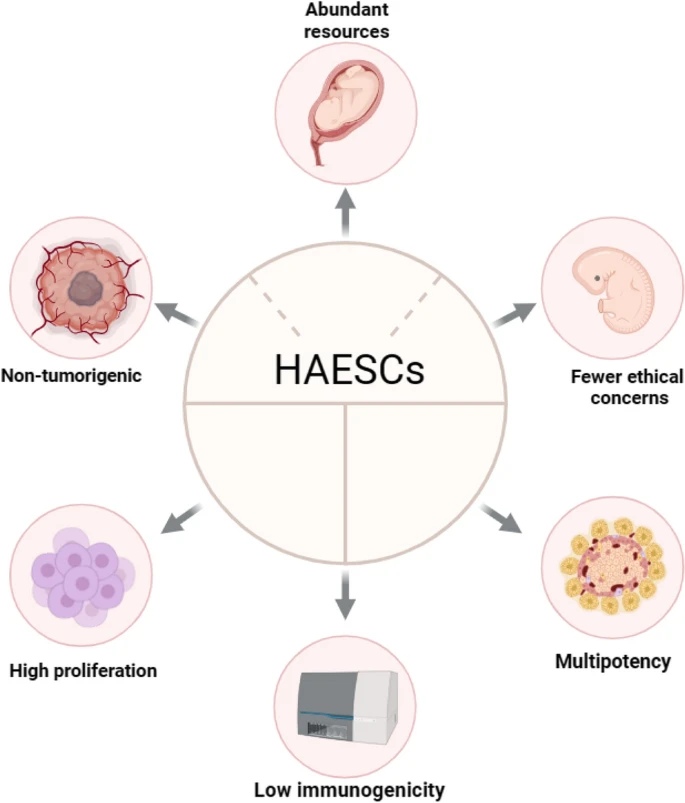
人羊膜上皮干細胞(hASCs)的六大特征
一、來源豐富:hAESCs來源于胎兒羊膜組織,每個胎兒在孕期均擁有羊膜囊,是易獲取的細胞來源。解離和擴增后,hAESCs增殖迅速,可形成大量均一的單細胞群,為醫學研究和治療提供了充足資源。與間充質干細胞(MSCs)相比,hAESCs不受倫理限制,成為替代干細胞來源。
二、倫理爭議少:胚胎干細胞(ESCs)因需破壞胚胎而存在倫理爭議,iPSCs的臨床轉化也面臨倫理質疑。hAESCs易于獲取、無致瘤性且免疫原性低,顯著減少了倫理爭議。
三、多能性:hAESCs表達OCT4、SOX2、NANOG等多能性標志物,并可分化為胰島素分泌細胞。研究發現,在無血清條件下,hAESCs可形成三維球體并分化為胰島素細胞,其超微結構顯示成熟分泌顆粒。透明質酸(HA)可增強胰腺發育相關基因表達,維持hAESCs表型和分化能力。DNA甲基化變化與hAESCs向胰島樣細胞分化相關,且與胰島細胞共培養可顯著改善糖尿病小鼠模型的移植效果。
四、高增殖能力:hAESCs在優化培養條件下(如 EGF 濃度10ng/ml)增殖迅速,平均倍增時間僅2天。不同培養基(DM、KO、UC)對hAESCs的增殖效率無顯著差異。
五、非致瘤性:hAESCs不表達端粒酶,在體內外均無致瘤性。實驗顯示,hAESCs注射至NOD-SCID小鼠后20周未引發腫瘤,而ESCs在8周內導致小鼠死亡。
六、低免疫原性:羊膜及其來源細胞具有免疫豁免特性,hAESCs可在異體內長期存活而不引發排斥反應。與胰島細胞共移植時,hAESCs的免疫抑制特性可保護β細胞功能,減少長期免疫抑制需求。
人羊膜干細胞在糖尿病中的治療潛力
hAESCs在糖尿病相關領域展現出顯著應用前景:
胰島類器官移植改善血糖控制:研究將hAESCs與胰島細胞(IC)共培養形成胰島類器官,并移植至糖尿病SCID小鼠。結果顯示,IC-hAESC 類器官組較單純胰島移植組血糖控制更佳,成功使高血糖小鼠模型血糖恢復正常。
血管化胰島類器官解決臨床挑戰:通過將hAESCs與人類臍靜脈內皮細胞(HUVEC)共培養,構建了血管化胰島類器官,有效解決了供體短缺、移植損傷及血管重建問題。hAESCs 不僅提高了細胞存活率和移植效率,還為 HUVEC 在移植組織中形成新生血管奠定了基礎。
分化為胰島素分泌細胞并提供免疫保護:hAESCs 在無血清條件下可分化為胰島素分泌細胞(IPCs),并通過 JAK1/2—STAT1/3 和 NF-κB1 通路分泌抗炎及免疫調節因子,保護胰島免受炎癥損傷。這一機制可減少移植后炎癥反應,提高胰島存活率,同時提供局部免疫保護,有望避免全身免疫抑制治療(圖2)。

人羊膜干細胞與8大糖尿病并發癥
一、糖尿病視網膜病變中的人羊膜干細胞
此外,hAESC還可用于治療2型糖尿病 (T2DM) 的血管并發癥。糖尿病視網膜病變的研究表明,hAESC 可以作為視網膜細胞的最佳替代品,在特定的培養條件下轉變為視網膜色素上皮 (RPE) 形態。來自 hAESC 的 RPE 樣細胞表現出類似于天然視網膜細胞的形態特征和標志物表達。當這些細胞被植入經典視網膜退行性疾病動物模型的視網膜下時,它們的視網膜結構和功能會顯著改善。
二、慢性腎臟病中的人羊膜干細胞
慢性腎病 (CKD) 是2型糖尿病 (T2DM) 的常見合并癥,兩種疾病的患病率都在增加。全球約有一半的 T2DM 患者患有 CKD,這會嚴重影響預后。這種疾病在老年人、青少年糖尿病患者、肥胖者、特定種族和弱勢群體中更為常見。T2DM 患病率的增加在中低收入國家最為明顯。
研究已證實hAESC在治療各種自身免疫和炎癥疾病方面具有潛力,并證明了其器官保護能力,且在使用過程中未觀察到顯著的不良反應。這種潛力在于它能夠有效抑制與疾病發展有關的免疫細胞活性(如中性粒細胞、巨噬細胞、效應T細胞和B細胞),同時還能誘導和增強抑制性免疫亞群(如調節性T細胞和Th2細胞)。值得注意的是,所有這些免疫細胞類型都在新月體性腎小球腎炎的進展中發揮關鍵作用,這表明hAESC可能同樣能夠通過類似的機制干預和控制腎小球損傷。
三、肝硬化中的人羊膜干細胞
糖尿病、肝硬化并發癥、非酒精性脂肪性肝病、酒精性肝硬化、慢性丙型肝炎和血色素沉著癥是常見的誘發因素。值得注意的是,肝硬化糖尿病患者的糖尿病癥狀可能不明顯,與微血管疾病的關系較少。這增加了肝硬化并發癥的風險。一般而言,hAESC條件培養基對肝細胞和肝祖細胞的作用與hAESC對肝纖維化的作用沒有顯著差異。然而,值得注意的是,hAESC條件培養基可顯著減少肝細胞損傷。此外,它對活化的造血干細胞和巨噬細胞有顯著的抑制作用,表明其具有減輕肝損傷和纖維化的潛力。
hAESC療法可通過多種機制支持肝臟再生。首先,這種療法會分泌EGF和IGF2等已知可刺激肝細胞增殖的生長因子。其次,鑒于纖維化基質是肝細胞增殖的重要抑制劑,hAESC的抗纖維化特性,尤其是其抑制HSC活化的能力,應有助于肝臟修復。
四、人羊膜干細胞在中風中的作用
糖尿病是眾所周知的中風風險因素,可誘發各個血管區域的病理變化。直接損害腦血管會導致中風。此外,血糖水平不受控制的中風患者的死亡率較高,從而阻礙中風后的恢復。嚴格管理糖尿病和其他相關風險因素是預防首次中風和復發性中風的有效策略。
研究表明,人胎盤細胞可增強體外和體內中風模型的功能恢復。通過刺激褪黑激素受體 MT1、增加細胞增殖和存活率、增強hAESC(如神經干細胞)的神經元分化,同時上調VEGF,這些細胞可在實驗性體外模型中保護機體免受缺血和氧化應激損傷。進一步的研究表明,在中風動物模型中,系統性應用hAESC可導致其優先遷移至脾臟和受損的腦組織,從而限制細胞凋亡和炎癥,減少早期免疫細胞浸潤,延緩梗塞進展,減輕全身免疫抑制,最終改善功能缺陷。
此外,一項研究檢查了靜脈注射hAESC和組織型纖溶酶原激活劑的保護作用,發現這種組合可以限制梗塞發展,減少血腦屏障破壞和腦出血,并降低24小時死亡率。
五、帕金森病中的人羊膜干細胞
糖尿病及其并發癥,如阿爾茨海默病 (AD) 和帕金森病 (PD),正在以驚人的速度增加。令人驚訝的是,大多數與代謝和神經退行性疾病有關的蛋白質壽命較長,因此容易受到糖基化的影響。值得注意的是,與糖尿病、AD和PD相關的蛋白質都具有這一特性。
研究表明,hAESC可以在側腦室中安全存活8周,而不會引起免疫排斥。此外,hAESC可提高海馬中的乙酰膽堿含量,從而改善空間記憶并修復受損的膽堿能神經元。展望醫療技術的未來,我們熱切期待掌握用于分離、培養、保存和輕松獲取高純度細胞群的先進技術。這可能會徹底改變阿爾茨海默病的治療,釋放巨大的潛力。
至關重要的是,研究發現,抗炎白細胞介素1受體拮抗劑可顯著提高多巴胺能神經元的存活率,首次證實了hAESC在PD小鼠模型中強大的抗氧化和抗炎作用。這一發現揭示了hAESC在PD疾病治療中的新型分子機制,為未來的臨床應用提供了新途徑。
六、人羊膜干細胞在卵巢功能障礙中的作用
糖尿病對女性卵巢生殖周期有廣泛影響,在1型糖尿病和2型糖尿病患者中表現不同。1型糖尿病女性易出現月經不調、青春期延遲和早期絕經。盡管治療取得了進展,但這些疾病仍然存在,可能會縮短生育壽命。相反,關于2型糖尿病女性(一個更復雜的群體)的研究結果不一致,未能發現與健康女性相比存在顯著的生殖衰老差異,盡管有更早絕經的趨勢。
研究顯示,將hAESC移植到卵巢切除小鼠體內,可在7天至2個月內恢復卵巢細胞的正常形態,并通過蘇木精和伊紅染色實驗證實這些細胞形成了不同階段的卵泡。免疫熒光和綠色熒光蛋白標記研究進一步顯示,成功移植的hAESC能夠存活并遷移至小鼠卵巢,最終分化為顆粒細胞。此外,接受hAESC移植治療的化療小鼠卵巢中,卵巢功能指標抗苗勒氏管激素顯著升高。本研究證實靜脈注射hAESC可有效到達化療小鼠卵巢,恢復卵泡生成能力。這一發現支持了hAESC在生殖健康領域的應用,有望提高女性癌癥患者的生活質量。
在多項研究中,hAESC在減輕化療引起的卵巢組織損傷方面的有益旁分泌活性受到了關注。將這些細胞注射到患有POI 的小鼠模型的卵巢中,可顯著促進血管生成、hUVEC的管道形成和卵泡發育。從機制上講,hAESC刺激TGF-β/Smad信號通路,從而減少細胞凋亡并促進卵泡生長。
七、心肌梗死-急性腎損傷中的人羊膜干細胞
糖尿病會顯著增加急性心肌梗死 (AMI) 的風險,并加劇由其他因素引起的急性腎梗死 (AKI) 的嚴重程度。最近的研究表明,即使在心臟病或腎臟疾病的早期階段,糖尿病也可能通過激活Toll樣受體和NADPH氧化酶衍生的活性氧,使腎臟更容易受到AMI引起的AKI的影響。
進一步的研究表明,hAESC具有分化為心肌細胞樣細胞的潛力,有可能減少梗塞面積并對心臟功能產生積極影響。此外,hAESC的治療效果可與來自臍帶血和脂肪組織的間充質干細胞相媲美。這些重大發現進一步強調了進一步研究 hAESC作為心臟再生細胞潛在來源的必要性。
此前有報道稱,hAESC如何顯著提高缺血再灌注損傷引起的AKI小鼠的存活率并有效減輕腎臟損傷。值得注意的是,hAESC的抗凋亡特性、促血管生成作用和免疫調節能力至少部分由旁分泌途徑介導。因此,hAECs-外泌體可以作為未來臨床治療中一種有前途的新工具,有可能克服傳統干細胞療法中遇到的局限性和風險,并使AKI患者受益。
八、人羊膜干細胞在糖尿病神經病變和傷口愈合中的作用
在糖尿病神經病變領域,研究表明人羊膜 (hAM) 療法可減輕神經纖維化并提高坐骨神經功能指數,表明其具有再生潛力。此外,hAM可有效治療糖尿病足,其能夠促進慢性潰瘍愈合、改善疼痛癥狀和生活質量。
一項研究還發現,hAESC可通過TGF-β信號調控來刺激細胞遷移和愈合。此外,在傷口愈合和組織重建中,hAESC經歷上皮-間質轉化,促進傷口閉合。HAESCs-外泌體可激活PI3K-AKT-mTOR通路,促進血管生成和成纖維細胞增殖和遷移,從而加速糖尿病傷口愈合,并在這一過程中發揮關鍵作用。此外,人類羊膜上皮干細胞通過旁分泌作用增強角質形成細胞和成纖維細胞的功能,抑制高血糖引起的細胞過早老化。
細胞衰老可能有助于慢性糖尿病傷口愈合,但hAESC通過釋放條件培養基增強角質形成細胞和成纖維細胞的遷移和增殖,從而增加膠原蛋白的產生和α-SMA的表達。在高血糖條件下,HAESC條件培養基可抑制ROS的產生,下調與衰老相關的SA-β-半乳糖苷酶活性,并降低持續高血糖引起的RAGE和P21升高。
HAESC通過調節炎癥和促進新血管形成來促進糖尿病傷口愈合。HAESCs培養基誘導巨噬細胞向M2表型極化,促進內皮細胞遷移、增殖和小管形成。此外,透明質酸水凝膠具有優異的機械性能、高彈性和良好的生物相容性,可延長羊膜來源培養基的釋放時間,通過巨噬細胞極化調節促進血管生成,顯著加速糖尿病傷口愈合。
綜上所述,hAESC在糖尿病傷口愈合中發揮著至關重要的作用,其關鍵信號通路包括PI3K-AKT-mTOR通路激活、旁分泌作用、炎癥調節和促進新生血管形成。
大量研究探討了 hAESC 在治療糖尿病及其相關并發癥中的效用和效力,并從動物實驗和臨床試驗中積累了令人鼓舞的數據。這些發現為開發新的治療策略和方法提供了重要的參考(表1)。
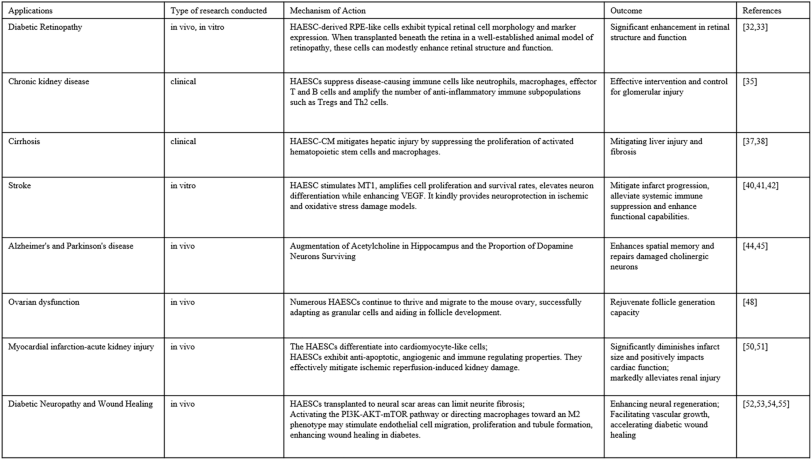
無論是hAESC衍生的細胞移植或用 hAESC 治療,還是hAESC釋放的分子,都可以改善高血糖和糖尿病進展等許多有害狀況。此外,hAESC還可顯著延緩糖尿病視網膜病變的進展,并改善慢性腎病、肝硬化、中風、帕金森病、卵巢功能障礙、心肌梗死-急性腎損傷、糖尿病神經病變和傷口愈合的功能恢復。
探索人羊膜干細胞的潛在臨床應用
HAESC療法是一種創新且有前景的治療方法,目前全球多個研究團隊正在積極開展臨床研究,并取得顯著進展。
2024年,《干細胞移植醫學》發表了一篇“人類羊膜上皮細胞移植對代償性肝硬化患者安全且耐受性良好:首次人體試驗”臨床研究的文章。

該臨床研究表明此期間本研究中使用的劑量對患有代償性肝硬化的患者進行同種異體 hAEC 靜脈輸注是安全且耐受性良好的。此外,肝靜脈壓力梯度(門靜脈高壓的指標)在4名患者中下降,在3名患者中沒有變化,在2名患者中增加。
該中心最近舉行的一次圓桌討論中也發現了類似的令人放心的趨勢,討論對象包括8名使用hAESC治療的急性中風患者。
細胞療法可能預示著新生兒肺部疾病管理的轉變。MSC和hAESC的臨床前研究前景看好,已促成針對支氣管肺發育不良 (BPD) 風險嬰兒的早期臨床試驗。內皮集落形成細胞 (ECFC) 和髓系血管生成細胞 (MAC) 是有望治療CDH或血管型BPD 表型嬰兒難治性肺動脈高壓癥狀的血管生成細胞,目前正處于概念驗證階段。從MSC和hAESC中吸取的經驗教訓可以加速這些細胞向安全、臨床可行產品的進展。
HAESC易于獲取,不存在倫理問題。它們不表達端粒酶,因此移植后既不會永生化也不會形成腫瘤。此外,人們注意到,當移植到肝臟中時,hAESC會表現出成熟肝臟中常見的基因。此外,它們與HLA-G表達相關的潛在免疫特權可能使接受者在接受hAESC移植時幾乎不會受到免疫抑制。
結論和觀點
糖尿病及其相關并發癥的治療方法已大大改善。HAESC因其免疫調節、抗炎、抗氧化和再生治療糖尿病的潛力而受到關注,在增強胰島功能、血管再生和炎癥調節等對抗糖尿病并發癥方面表現出良好的前景。
然而,在hAESC治療能夠臨床實施之前,長期細胞存活、功能成熟和免疫排斥仍是未解決的問題。因此,未來的研究應側重于提高hAESC的治療效果,包括改進移植方法、改善移植微環境以及增強細胞存活和功能。此外,了解 hAESC 的作用機制對于理解其在糖尿病及其相關并發癥治療中的作用至關重要。
總之,本綜述進一步證實,盡管hAESC仍處于研究階段,但它們在治療糖尿病并發癥方面具有巨大潛力。通過解決當前問題并加深我們對hAESC作用機制的理解,未來的hAESC治療可以為糖尿病及其相關并發癥患者帶來新的希望。
參考資料:Chen, Z., Luo, Y. & Liu, J. Human amniotic epithelial stem cells, a potential therapeutic approach for diabetes and its related complications.?Human Cell?38, 39 (2025). https://doi.org/10.1007/s13577-024-01171-x
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信