糖尿病(DM)是由多種病因導致的綜合征,以代謝功能障礙及胰島素生成、分泌或其作用效能受損為特征。
目前2型糖尿病治療面臨三大難題:胰島素抵抗與β細胞功能衰退致控糖難,現有藥物難以模擬生理分泌且存在副作用;傳統降糖方案側重血糖數值,對心腎等靶器官保護不足,并發癥防控復雜;患者依從性受飲食運動管理、多藥聯用復雜性、個體代謝差異及經濟負擔等影響,個體化治療優化難度大。
干細胞治療301名2型糖尿病的臨床數據分析表明:顯著改善血糖、肝腎功能及全身炎癥
近期,馬來西亞森美蘭州芙蓉CMH專科醫院心臟科的研究團隊在這個難題上邁出了重要一步,研究人員旨在通過多種臨床評估,評估靜脈輸注同種異體臍帶間充質干細胞 (UC-MSCs) 對2型糖尿病患者的臨床療效,重點關注全身炎癥、代謝功能障礙和胰島素抵抗。

結果數據表明同種異體UC-MSCs輸注對2型糖尿病患者安全,且與整體健康狀況相關,且獲益可持續長達12個月。值得注意的是,該治療顯著改善了代謝指標,包括血糖控制、肝腎功能以及全身亞臨床炎癥。這些發現為進一步探索UC-MSCs在合適的隨機對照試驗中治療2型糖尿病(通過同時解決代謝失調和炎癥)奠定了基礎。
相關研究數據結果發表在國際期刊雜志《Diabetes Metab Syndr Obes》上[1]。
糖尿病的定義、分型及治療挑戰概述
定義與流行病學:糖尿病(DM)是由多種病因導致的綜合征,以代謝功能障礙及胰島素生成、分泌或其作用效能受損為特征。據國際糖尿病聯盟(IDF)數據,2019年全球成人糖尿病患病率達9.3%,若未采取有效防控措施,預計2030年將升至10.2%,2045年達10.9%,該病已成為高死亡率與發病率的主要誘因之一。

分型與病理機制:糖尿病主要分為1型(T1DM)和2型(T2DM),其中T2DM占病例總數的90-95%。
其特征為成人發病的胰島素感知功能障礙(胰島素抵抗),風險因素包括高熱量飲食、缺乏運動、遺傳、年齡、吸煙、壓力、睡眠障礙、腹部肥胖及炎癥。
慢性炎癥是T2DM的核心觸發機制,持續高血糖可導致糖尿病腎病、視網膜病變、神經病變、心血管疾病及糖尿病足等并發癥,顯著降低患者生活質量。
治療局限與需求:控制血糖、減少并發癥需持續的生活方式干預及藥物治療。盡管飲食管理、運動及口服降糖藥有效,多數患者仍需胰島素治療。現有藥物均未直接靶向炎癥通路,因此亟需創新療法。
為什么選擇干細胞療法治療疾病?有什么潛力?
干細胞研究為多種疑難疾病提供新治療方向。間充質干細胞(MSCs)因具自我更新、多向分化、低免疫原性及體外增殖能力,并能分泌修復受損組織的營養因子,成為臨床研究熱點(截至2025年6月12日,臨床trials.gov注冊試驗達1316項)。其來源包括脂肪、骨髓、胎盤、羊膜、臍帶(UC)及臍帶血(CB)。
為什么這次選擇臍帶間充質干細胞治療2型糖尿病?
臍帶間充質干細胞優勢:人臍帶間充質干細胞(UC-MSCs)因獨特屬性成為優選:較成熟組織來源的MSCs更原始,增殖與自我更新能力更強,且具備關鍵性旁分泌效應(分泌生長因子、抗炎細胞因子及胞外囊泡)。
臍帶作為醫療廢棄物,采集無倫理爭議,使其在心血管、神經、自身免疫及內分泌疾病治療中前景廣闊。研究證實Cytopeutics?UC-MSCs安全性高,高劑量下仍具強效免疫調節作用,低免疫原性支持同種異體移植。
相較于別的臨床研究,本臨床研究能補充哪些數據缺口與目標
多項臨床研究已探索了UC-MSC在治療2型糖尿病中的應用。然而,一些研究僅側重于評估糖尿病代謝特征,而另一些研究則檢查了免疫學指標等其他標志物,而沒有考慮其他臨床標志物。臨床標志物(包括物理測量和生化標志物)在監測糖尿病病情進展和治療效果中起著關鍵作用。我們之前已證明UC-MSC在健康志愿者中具有劑量依賴性的免疫調節和抗炎作用。評估MSCs對2型糖尿病有益作用的臨床研究有限。
因此,我們旨在探索靜脈同種異體UC-MSCs輸注對2型糖尿病患者的影響,特別關注血糖控制、代謝功能障礙和全身炎癥。該分析為設計適當的隨機對照臨床試驗提供指導,并進一步探索UC-MSCs在糖尿病治療中的潛力。
方法:本研究包括2014年11月至2022年7月期間在參與中心接受過UC-MSCs輸注的糖尿病患者。共選擇了301名糖尿病患者,因為他們符合納入和排除標準,如表1所示。

在301名患者中,218例接受50-100×10?異基因臍帶間充質干細胞移植后6個月隨訪的2型糖尿病患者,83例接受12個月隨訪的2型糖尿病患者的數據。患者基線人口統計學特征見表2。

評估干細胞治療2型糖尿病的療效,為什么時間區間在6個月、12月,而不是在3個月?
干細胞治療2型糖尿病的療效評估需設定6個月和12個月的關鍵時間點,而非僅依賴3個月短期數據,主要基于以下核心原因:
療效顯現與穩定的時間規律:干細胞通過免疫調節(如促進巨噬細胞向M2型轉化)、組織修復(如胰島β細胞功能恢復)及改善胰島素抵抗等機制發揮作用,這些生物學過程具有漸進性。臨床研究顯示,代謝指標如糖化血紅蛋白(HbA1c)通常在9周左右出現顯著下降,但此后可能小幅回升,需持續觀察至6個月才能確認療效是否穩定;而12個月的評估則用于驗證效果的長期維持性,避免短期波動誤導結論。
治療目標的動態性:核心終點如胰島素用量減少、脫離胰島素依賴等,需足夠時間窗口才能體現。例如,在解放軍總醫院的II期臨床試驗中,患者脫離胰島素依賴的時間集中在治療后8-24周(平均12周),且維持無胰島素狀態長達37周,此類關鍵療效在3個月內難以充分觀測[2]。
安全性及持續性的綜合考量:干細胞治療需排除遲發性不良反應(如免疫反應或代謝反彈),而多項薈萃分析表明,胰島素需求量減少和HbA1c改善在3個月時僅初現趨勢,至6個月后才呈現統計學顯著差異,且效果可持續至12個月以上。
綜上,6個月是療效趨于穩定的關鍵節點,12個月則評估長期安全性及效果持續性,兩者結合方能全面反映干細胞治療的臨床價值,而3個月僅能提供早期趨勢提示,不足以作為療效定論依據。
評估干細胞治療2型糖尿病有效性指標體系
有效性定義為以下參數相對于基線的變化:
- 糖代謝指標:空腹血糖、糖化血紅蛋白、胰島素水平、胰島素抵抗指數(HOMA-IR)
- 血脂譜:總膽固醇、甘油三酯、高/低密度脂蛋白及其比值
- 肝功能:總蛋白、白蛋白、球蛋白、堿性磷酸酶、γ-谷氨酰轉移酶、谷草/谷丙轉氨酶
- 腎功能:肌酐、估算腎小球濾過率、尿酸、血尿素氮
- 激素譜:睪酮、黃體生成素、雌二醇、胰島素樣生長因子-1、硫酸脫氫表雄酮、卵泡刺激素
- 炎癥標志物:高敏C反應蛋白(hs-CRP)
通過上述多維度臨床指標變化評估個體療效。
01、體質測量評估
首次測量的BMI和腰臀比與隨訪6個月和12個月時相比,差異無統計學意義(表3)。但隨訪12個月時收縮壓(SBP)顯著下降(圖1A)(p<0.05),6個月和12個月時舒張壓(DBP)也顯著下降(圖1B)(p<0.05)(表3)。
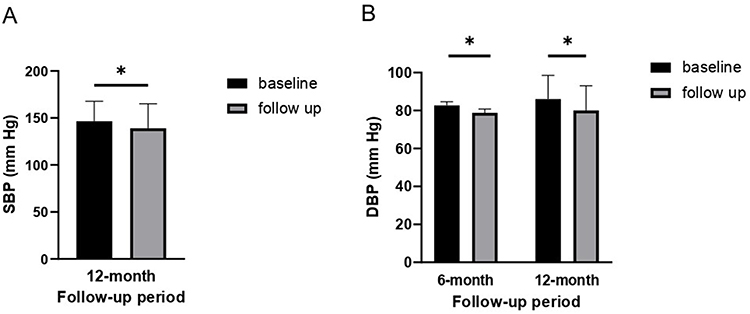

縮寫:BMI,身體質量指數;SBP,收縮壓;DBP,舒張壓;HbA1c,血清糖化血紅蛋白;FBS,空腹血糖;HOMA-IR,胰島素抵抗穩態模型評估;HDL,高密度脂蛋白;LDL,低密度脂蛋白;ALP,堿性磷酸酶;GGT,γ-谷氨酰轉移酶;AST,天冬氨酸轉氨酶;ALT,丙氨酸轉氨酶;eGFR,估計腎小球濾過率;LH,黃體生成素;IGF1,胰島素樣生長因子-1;DHEAS,硫酸脫氫表雄酮;FSH,促卵泡激素;hs-CRP,高敏C反應蛋白。
02、療效評估:糖尿病代謝指標
UC-MSCs輸注后,糖代謝指標呈現以下變化:
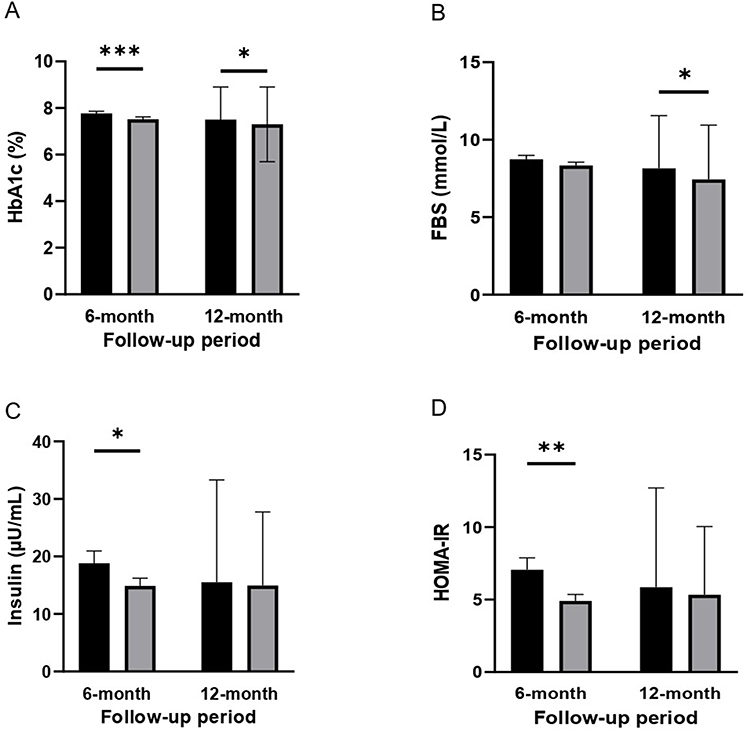
- 糖化血紅蛋白(HbA1c):6個月隨訪期:基線值7.77±0.10%顯著降至7.52±0.10%(p<0.001),12個月隨訪期:基線中位數7.50%顯著降至7.30%(p=0.016)(圖2A/表3)。
- 空腹血糖(FBS):6個月呈下降趨勢但未達顯著(p=0.086),12個月顯著降低(p=0.016)(圖2B)。
- 胰島素水平:輸注6個月后顯著下降(p=0.048)(圖2C)。
- 胰島素抵抗指數(HOMA-IR):6個月顯著改善(p=0.007),12個月基線中位數5.86降至5.33,呈改善趨勢但未達統計顯著(p=0.081)(圖2D)。
03、療效評估:血脂狀況
總膽固醇、甘油三酯、高密度脂蛋白 (HDL)、低密度脂蛋白 (LDL) 及高密度脂蛋白比值在初次測量與6個月和12個月隨訪之間均無顯著變化(表3)。
研究期間,上述所有參數均維持在正常范圍內(正常參考范圍:總膽固醇 (3.40–5.20 mmol/L);甘油三酯 (0.40–1.70mmol/L);高密度脂蛋白 (>1.04);低密度脂蛋白 (<2.60);高密度脂蛋白比值 (3.0–5.0))。
04、療效評估:肝臟狀況
肝臟轉氨酶顯著改善:γ-谷氨酰轉移酶(GGT)在6個月隨訪時顯著降低(p=0.004,圖3A)。
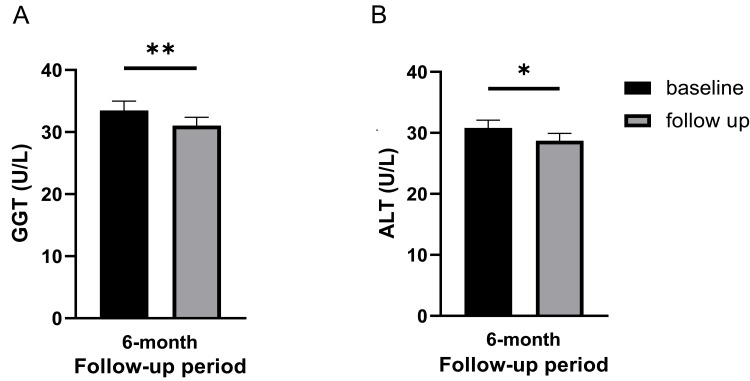
谷丙轉氨酶(ALT)在6個月隨訪時顯著降低(p=0.015,圖3B),其余指標(總蛋白、白蛋白、球蛋白、堿性磷酸酶ALP、谷草轉氨酶AST)在隨訪期間均無顯著波動,且始終維持在正常范圍內(表3)(參考范圍:總蛋白65–83g/L;白蛋白38–53g/L;球蛋白23–35g/L;ALP35–104U/L;GGT<50U/L;AST10-27U/L;ALT 5–33U/L)。
05、療效評估:腎功能指標分析
根據KDOQI指南45,慢性腎病(CKD)基于估算腎小球濾過率(eGFR)閾值分為不同階段。表4展示了191例患者的eGFR值,其中140例來自6個月隨訪、51例來自12個月隨訪,均記錄eGFR以確定CKD分期。對CKD2-5期患者進一步開展腎功能評估(表5)。
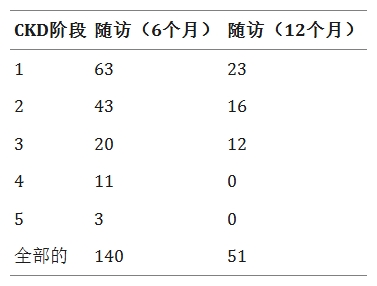
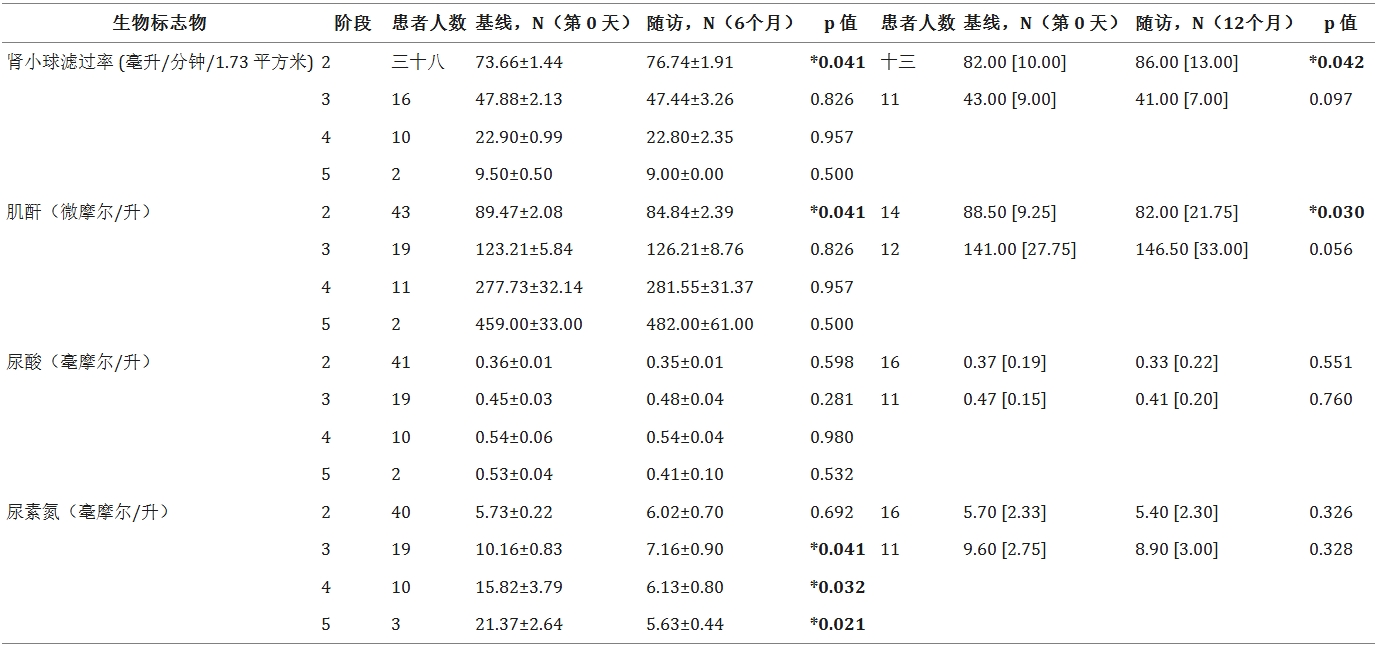
結果顯示:
- CKD2期:6個月和12個月隨訪時,eGFR顯著上升,肌酐水平同步下降(6個月eGFR: p=0.041;12個月eGFR: p=0.042;肌酐p值分別為0.041和0.030)。
- CKD3-5期:隨訪期間eGFR與肌酐水平均無顯著變化。
- 尿酸:所有分期在隨訪中均未出現顯著波動。
- 血尿素氮(BUN):CKD2期隨訪期BUN無變化;CKD3/4/5期在6個月隨訪時BUN顯著降低至正常參考范圍(2.9–8.2mmol/L)(p值分別為0.041、0.032、0.021)。
06、療效評估:激素概況
在12個月的隨訪期間,男性患者的睪酮水平有所升高(p=0.050;圖4A)。女性患者的雌二醇水平在12個月的隨訪期間顯著升高(p=0.043;圖4B)。
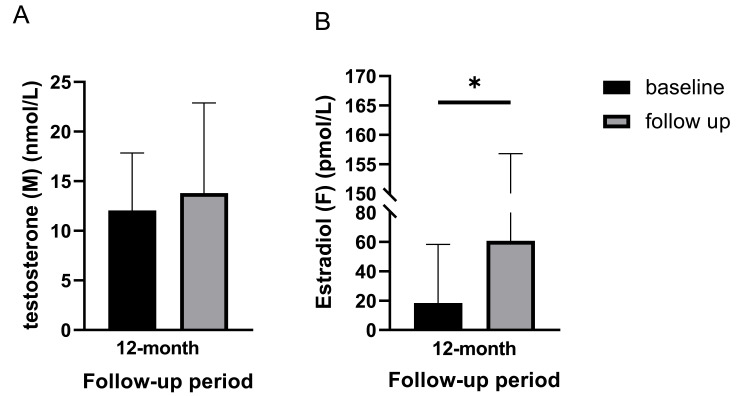
然而,男性患者的雌二醇水平在基線和隨訪期間(6個月和12個月)均無顯著差異;男性患者的LH、IGF-1、DHEAS以及FSH水平在兩性患者中均無顯著差異(表3)。
07、療效評估:炎癥概況
本研究炎癥指標評估顯示:整體人群的hs-CRP水平在隨訪期間雖數值降低,但無統計學顯著性;而高炎癥亞組(hs-CRP≥1.50mg/L) 表現出顯著臨床改善——12個月隨訪時hs-CRP中位數從3.39mg/L顯著下降至1.45mg/L(p=0.016),且達到正常參考范圍(≤3.00mg/L),6個月隨訪時亦觀察到下降趨勢(p=0.073)(表3/圖5)。

最終研究結果給我們帶來哪些臨床價值?
糖尿病已成為60歲以下人群的主要死因,其中2型糖尿病(T2DM)占比超90%。多項研究表明間充質干細胞(MSCs)可能有效管理糖尿病。
基于此,本回顧性分析旨在評估靜脈輸注異體Cytopeutics? UC-MSCs對T2DM患者糖尿病控制、全身炎癥、代謝功能障礙及胰島素抵抗的療效。
臍帶間充質干細胞移植治療顯著改善2型糖尿病的核心代謝指標
證據與機制
HbA1c持續下降:本研究中,HbA1c在6個月隨訪時顯著降低,且效果持續至12個月隨訪,表明UC-MSCs能有效降低T2DM患者HbA1c長達一年,與既往研究一致。
機制關聯:評估HbA1c下降是判斷MSCs治療糖尿病臨床療效的關鍵指標(美國糖尿病協會ADA推薦)。與血糖和尿糖檢測不同,HbA1c可反映2-3個月的長期血糖控制情況,是治療成敗的可靠標志。
胰島素抵抗逆轉:輸注UC-MSCs后HOMA-IR顯著下降,表明胰島素抵抗減輕,并在6個月隨訪時實現胰島素分泌水平正常化。
關鍵意義:本研究中T2DM患者基線胰島素水平升高,提示存在胰島素抵抗(機體對胰島素反應低下迫使胰腺代償性增加分泌)。
胰島素抵抗穩態模型評估(HOMA-IR)可獨立預測T2DM發生風險(與肥胖、體脂分布及糖耐量狀態無關)。其改善表明UC-MSCs靶向了疾病核心病理機制。
UC-MSCs通過抗炎作用調控全身代謝穩態
炎癥與代謝的交互機制
hs-CRP動態降低:UC-MSCs治療后,基線hs-CRP≥1.5mg/L的T2DM患者在6個月隨訪時呈下降趨勢,12個月隨訪時顯著降低(降至正常參考范圍≤3.00mg/L)。該結果支持了CRP升高與高血糖相關的假說。同期HbA1c的同步下降提示UC-MSCs可能通過減輕炎癥改善血糖控制。
科學依據:CRP是由肝臟合成、受IL-6和腫瘤壞死因子α(TNF-α)等促炎因子調控的急性期反應物,是全身炎癥的高度敏感標志。既往研究已確立hs-CRP是全身低度炎癥標志物,其升高與T2DM風險直接相關。
炎癥網絡與代謝紊亂:脂肪組織釋放的ROS、IL-6、TNF-α等因子通過招募免疫細胞放大胰島炎癥,導致β細胞凋亡和外周胰島素抵抗。
治療意義:UC-MSCs可能通過抑制促炎因子(如IL-6/TNF-α)釋放,阻斷”炎癥-胰島素抵抗”惡性循環。
肝腎器官效應保護機制拓展治療價值
肝臟與腎臟功能改善
近40年多項研究報道糖尿病患者γ-谷氨酰轉移酶(GGT)升高率高。GGT升高與氧化應激增強相關,可能導致β細胞功能障礙和胰島素作用受損。
肝臟獲益:UC-MSCs輸注后肝功能顯著改善,表現為6個月隨訪時γ-谷氨酰轉移酶(GGT)和丙氨酸氨基轉移酶(ALT)水平下降。
機制關聯:胰島素抵抗驅動脂肪肝(NAFLD),GGT升高反映氧化應激損傷β細胞功能;UC-MSCs通過改善代謝/炎癥減輕肝臟負擔。
腎臟保護
糖尿病腎病(DKD)是慢性腎臟病(CKD)的主要病因,全球患病率5-7%,糖尿病和高血壓是其首要危險因素。糖尿病患者發生CKD的風險近翻倍,約20-50%的T2DM患者罹患DKD。
因此延緩DKD進展、推遲終末期腎病(ESKD)至關重要。本研究中約24%的T2DM患者估算腎小球濾過率(eGFR)<60mL/min/1.73m2(3-5期),提示腎功能顯著喪失;而多數DKD患者處于CKD2期(占比約31%)。
eGFR提升:UC-MSCs輸注顯著改善2期CKD患者的eGFR并降低肌酐水平,表明MSCs治療可能修復腎組織功能并延緩DKD進展(與既往研究一致)。
關鍵機制:全身炎癥在DKD發病中起關鍵作用,高血糖誘導的氧化應激和炎性因子激活NF-κB、JAK/STAT等通路,導致腎組織損傷和纖維化。本研究觀察到的hs-CRP和血壓下降可能減輕早期DKD炎癥反應,從而促進腎臟修復并提升濾過能力。
性激素調節揭示性別差異化治療潛力
性別特異性代謝調控
男性睪酮水平上升:男性患者睪酮水平在12個月隨訪時顯著上升。T2DM男性常伴低血清睪酮,這與胰島素敏感性下降和脂肪肝浸潤相關。
機制關聯:睪酮可上調GLUT4表達增強葡萄糖攝取,其恢復或間接改善胰島素抵抗。
女性雌二醇水平上升:類似地,女性患者12個月隨訪時雌二醇水平顯著上升也可能改善胰島素敏感性——研究證實雌二醇通過作用于脂肪組織、骨骼肌、肝臟和胰腺β細胞等多途徑發揮抗糖尿病效應。
臨床意義:性激素水平改善為UC-MSCs調控代謝提供了新視角,尤其契合男性早發、女性晚發的流行病學特征。
寫在最后:臍帶間充質干細胞成為治療2型糖尿病新興的治療方法
綜上所述,所有患者均獲得了令人滿意的療效,且未出現任何不良反應。我們的研究結果支持了MSC輸注與2型糖尿病患者糖化血紅蛋白(HbA1c)水平顯著降低和胰島素抵抗之間的關聯。
UC-MSC治療還顯著降低了hs-CRP水平,提示全身炎癥減輕,同時血糖控制得到改善。此外,肝腎功能的改善以及可能增強胰島素敏感性的激素變化,進一步證明了該療法的多方面益處。
這些研究結果為開展一項精心設計的隨機臨床試驗以驗證UC-MSC輸注對2型糖尿病的療效提供了指導。
主要參考資料:
[1]Chin SP, Kee LT, Mohd MA, Then KY. Umbilical Cord-Derived Mesenchymal Stem Cells Infusion in Type 2 Diabetes Mellitus Patients: A Retrospective Cytopeutics’ Registry Study. Diabetes Metab Syndr Obes. 2025 May 19;18:1643-1659. doi: 10.2147/DMSO.S507801. PMID: 40416928; PMCID: PMC12102742.
[2]:Zang, L., Li, Y., Hao, H. et al. Efficacy and safety of umbilical cord-derived mesenchymal stem cells in Chinese adults with type 2 diabetes: a single-center, double-blinded, randomized, placebo-controlled phase II trial. Stem Cell Res Ther 13, 180 (2022). https://doi.org/10.1186/s13287-022-02848-6
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信