繼發性腎病是全球慢性腎臟病(CKD)的首要病因,其由糖尿病、高血壓、自身免疫病等系統性疾病引發,每年導致數百萬人進展至終末期腎病(ESRD),亟需突破性治療方案。 傳統療法(如控制血糖、血壓或免疫抑制劑)雖能延緩病情,但難以逆轉已發生的腎臟損傷,且長期使用副作用顯著。干細胞治療的興起,為這一難題帶來了革命性希望。
通過修復受損腎組織、調節異常免疫反應、抑制纖維化進程,干細胞療法已在糖尿病腎病、高血壓腎病、狼瘡性腎炎等繼發性腎病中展現出顯著療效。
本文基于多項臨床研究與機制探索,系統解析干細胞治療繼發性腎病的科學原理、療效證據及未來發展方向,為患者和醫療從業者提供權威、全面的治療策略參考。
從糖尿病到狼瘡腎炎:干細胞能否治療繼發性腎病?
一、干細胞治療繼發性腎病的作用機制
干細胞通過以下核心機制改善腎臟損傷:
1. 多向分化與組織修復
- 歸巢性:干細胞可定向遷移到腎臟損傷部位(如腎小球、腎小管),分化為腎小球上皮細胞、腎小管上皮細胞等腎固有細胞,替代受損細胞并修復組織結構。
- 血管再生:分泌血管內皮生長因子(VEGF)、肝細胞生長因子(HGF)等,促進腎臟微血管新生,改善缺血缺氧環境。
2. 免疫調節與抗炎作用
- 抑制炎癥反應:通過分泌抗炎因子(IL-10、TGF-β)和抑制促炎因子(TNF-α、IL-6),減輕腎臟炎癥損傷。
- 調節免疫平衡:促進調節性T細胞(Treg)增殖,抑制過度活化的T細胞和B細胞,減少免疫復合物沉積(如糖尿病腎病中的免疫炎癥)。
3. 抗纖維化與保護腎功能
- 抑制纖維化信號通路:通過阻斷TGF-β/Smad通路,減少膠原沉積,延緩腎間質纖維化。
- 促進細胞自噬:清除受損細胞器,維持腎細胞穩態。
二、臨床研究證據:療效與安全性
案例1:干細胞治療糖尿病腎病的療效和安全性
2024年,江西贛南醫科大學研究人員在國際期刊《medRxiv》上發表一篇有關《干細胞治療糖尿病腎病的療效和安全性:系統評價與薈萃分析》的綜述,該綜述大體意思是江西贛南醫科大學的研究人員整合了3,528項研究,并且在3528項研究篩選了4項干細胞治療糖尿病腎病的高質量臨床研究,并對這四項高質量研究進行了系統評價與薈萃分析。

臨床研究結果:
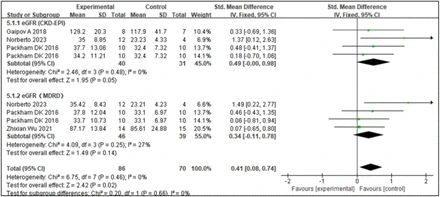
1.干細胞移植對腎小球濾過率(eGFR)的影響:估計的腎小球濾過率(eGFR)是腎功能的重要指標。腎臟疾病飲食調整和慢性腎臟病流行病學協作公式通常用于估算GFR。四項研究表明,干細胞移植顯著改善了eGFR水平。森林圖數據分析(圖1)顯示,與對照組的結果相比,SCT作為干預措施顯著改善了eGFR水平。
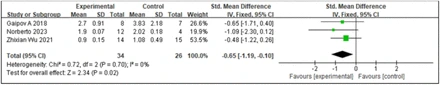
2.干細胞移植對血清肌酐(SCR)的影響:SCr水平可用于監測DKD。在DKD早期,SCr可維持在正常范圍,但隨著病情進展,其水平逐漸升高,因此監測SCr水平對DKD的早期診斷和病情監測有重要意義。3項研究報道了SCr水平,其相關的I2值為0%,因此本研究采用固定效應模型。森林圖分析結果(圖2)顯示,SCT治療與SCR水平的顯著變化相關,以干細胞注射為干預措施的試驗組糖尿病患者的SCR水平顯著降低。
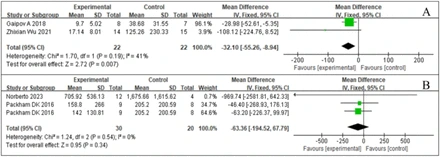
3.干細胞移植對MAU的影響:微量白蛋白尿(MAU)是DKD的早期標志。持續性MAU與糖尿病患者發生臨床蛋白尿的風險呈顯著正相關,提示MAU對預防DKD發展至關重要。兩項研究對MAU進行了綜合分析,如圖3A所示。SCT與MAU水平的顯著變化相關,研究間異質性較低,I2值為41,提示研究結果一致性較高。森林圖數據分析顯示,SCT組的MAU水平顯著低于對照組。
4.干細胞移植對UACR的影響:UACR是尿蛋白排泄指標,是早期篩查DKD的關鍵參數。UACR升高預示腎臟損傷的存在,尤其對于糖尿病患者。整合現有數據,我們直觀地展示了UACR的研究結果(圖6B)。經統計學分析,SCT在降低UACR方面的作用未達到統計學意義的要求。此外,研究間異質性較低。試驗組和對照組之間的UACR無顯著差異。
5.不良反應:關于注射干細胞的安全性,我們對干細胞移植引起的不良反應的研究進行了薈萃分析,結果發現不良事件或嚴重不良事件均無顯著差異,表明其安全性與現有療法相當,未增加額外風險。(見圖4)
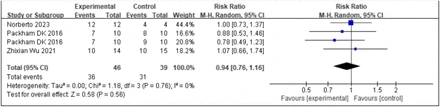
綜上所述,本研究結果提示干細胞移植可作為糖尿病腎病的潛在治療方式,可顯著改善eGFR、降低SCr、降低MAU,從而減輕腎臟損害。
案例2:間充質干細胞治療傳統方法無效的狼瘡性腎炎臨床療效
2023年,哈薩克斯坦阿斯塔納國家科學醫學中心在期刊《腎臟病透析移植》上發表了一篇關于《間充質干細胞移植治療狼瘡性腎炎的免疫矯正新焦點 》的臨床研究結果。

本次研究總共納入了15名對傳統免疫抑制療法有抵抗力的SLE(ACR標準)患者。
對患者骨髓間充質干細胞移植效果的監測顯示,12個月后,SELENA-SLEDAI評分活動性顯著下降2倍,從 14.67±1.15分降至7.33±1.15分。在對照組中,盡管持續進行免疫抑制治療,但該指標保持不變,為 15.0±0.87分。
所有接受高劑量免疫抑制療法(HIST)和骨髓間充質干細胞(MSC)移植的患者均表現出臨床療效,其表現為:
- 每日蛋白尿量從2.48±0.77降至1.06±0.56g/l
- DNA抗體值(從443.28±547.53降至187.8±146.60)
- 血液細胞因子(TNF-Α顯著降低)降低;
- 補體水平升高(盡管不顯著)。
根據腎活檢數據,在接受HIST的MSC移植后,積極的動態包括腎小球血管環中網狀纖維的數量增加,以及通過對抗體譜的免疫熒光分析發現腎小球血管環中的免疫炎癥過程減少。(見圖5)
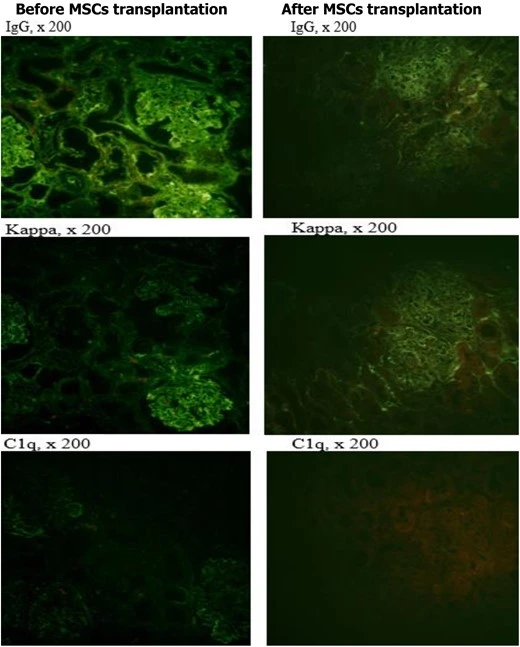
綜上所述,根據臨床和實驗室數據,間充質干細胞移植與高劑量免疫抑制療法相結合對SLE的療效顯著優于傳統單一免疫抑制方案。同時,MSC移植安全性良好,并可以減少自身免疫攻擊的跡象,可用于SLE標準療法無效、療效低或不耐受的患者情況。
案例3:干細胞治療高血壓引起的慢性腎病患者Ⅱ期臨床試驗療效
2020年,中國臺灣高雄長庚紀念醫院以及長庚大學醫學院內科心臟內科在行業期刊《干細胞轉化醫學》上發表了一篇關于《腎動脈自體CD34+細胞輸注治療慢性腎病患者的安全性和有效性》的一項隨機、開放標簽、對照的II期臨床試驗結果。

本Ⅱ期臨床試驗共納入52例連續入組的慢性腎臟病(CKD)III期或IV期患者,所有受試者均隨機分配至治療組。入組標準要求患者在發展為CKD前存在明確的高血壓病史,并且在試驗前已接受規范化的抗高血壓治療,包括血管緊張素轉換酶抑制劑(ACEI)、血管緊張素II受體拮抗劑(ARB)、鈣通道阻滯劑(CCB)或β受體阻滯劑等藥物的最佳劑量治療。
1.治療效果與細胞變化
- 患者情況:所有患者接受CD34+細胞治療后都順利出院。
- 細胞比較:治療組和對照組患者在治療前,體內幫助修復血管的“祖細胞”(EPC)數量基本相同。
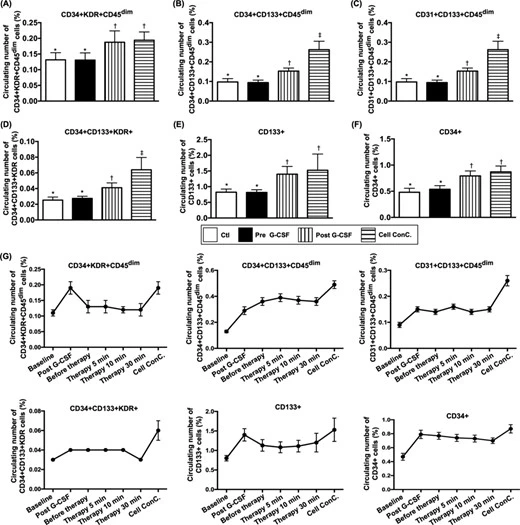
- 關鍵發現:但接受G-CSF藥物(一種促進細胞活動的藥物)的患者(第1組),這些修復血管的EPC數量明顯增加,尤其是在血液中的水平顯著上升(如圖6A-F所示)。
2.細胞如何被調動到血液中
通過特殊檢測(流式細胞分析)發現:
- 細胞流動方向:G-CSF藥物能促使骨髓中的修復細胞(EPC和HSC)不斷從腎臟(右腎靜脈)進入血液循環(如圖2F)。
- 細胞數量變化:用藥后,這些患者的血液中修復細胞(EPC和HSC)數量大幅增加(如圖2G),說明G-CSF像“召集令”一樣,把骨髓里的細胞“調動”到了血液中。
3.血管修復能力的變化
- 血管生成能力:通過實驗(Matrigel測定)發現,用藥前兩組患者形成新血管的能力(如形成血管簇、連接成管等)幾乎一樣。
- G-CSF的效果:但用藥后,第1組患者的血管修復能力顯著增強,這進一步證明G-CSF能有效調動骨髓中的修復細胞到血液中,幫助修復血管(如圖7)。
- 血漿中的秘密:特別有意思的是,含有這些修復細胞的血液樣本中,促進血管生成的能力最強。
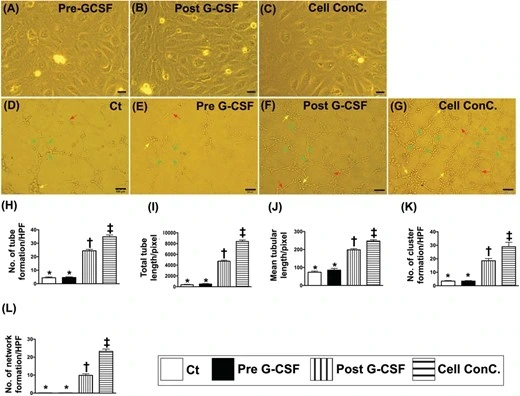
綜上所述,這項研究通過藥物(G-CSF)成功“激活”了骨髓中的修復細胞(EPC和HSC),并將其“調動”到血液中。這些細胞幫助患者生成新的血管網絡,從而改善腎臟血流和功能。接受這種治療的患者不僅康復順利,而且治療后的血管修復能力顯著增強,說明G-CSF聯合干細胞療法可能成為高血壓形成的慢性腎病治療的新選擇。
三、干細胞療法的治療優勢與挑戰
1.核心優勢
多靶點干預:同時修復組織、調節免疫和代謝,突破傳統藥物的單一作用模式。
減少藥物依賴:降低激素用量,避免長期使用ACEI/ARB類藥物的副作用(如高鉀血癥)。
安全性較高:間充質干細胞幾乎沒有免疫排斥風險,并且臨床數據顯示感染、過敏等副作用發生率低于傳統免疫抑制劑。
2.主要挑戰
療效異質性:不同來源(如臍帶、骨髓、脂肪)的干細胞效果差異顯著,且患者年齡、基礎疾病狀態影響治療應答。
最佳治療方案未統一:干細胞類型、劑量、輸注途徑(靜脈或局部注射)及治療時機尚無共識。
未來展望
1.聯合治療策略:干細胞療法需與傳統手段(如降壓、降糖)結合,綜合控制原發病,提升整體療效。
2.技術創新方向
- 基因編輯與工程化改造:通過CRISPR技術增強干細胞的定向分化能力或抗炎特性。
- 細胞外囊泡療法:利用干細胞分泌的囊泡作為無細胞治療載體,規避安全風險。
3.推動臨床轉化
需加強國際合作,建立標準化療效評價體系,加速從基礎研究到臨床應用的轉化。我國已啟動多項多中心臨床試驗,預計未來5-10年有望形成規范化治療方案。
結語
干細胞治療為繼發性腎病提供了修復損傷、延緩進展、改善生活質量的全新策略。其通過分化修復、免疫調節和抗纖維化機制,顯著改善糖尿病腎病、狼瘡性腎炎等疾病的臨床指標。盡管仍需解決標準化問題,但隨著基因編輯、類器官技術及精準醫療的推進,干細胞有望成為繼發性腎病治療的“游戲規則改變者”,為患者爭取更長的無透析生存期與更好的生活質量。
相關閱讀:干細胞治療原發性腎病:患者能否受益?機制與臨床進展揭秘
參考資料:
Natalya Krivoruchko, Lina Zaripova, Manarbek Askarov, Abay Baigenzhin, Temirlan Karibekov, Galiya Shaimardanova, Saltanat Bekturganova, #2733 TRANSPLANTATION OF MESENCHYMAL STEM CELLS – NEW FOCUS OF IMMUNE CORRECTION IN TREATMENT OF LUPUS NEPHRITIS, Nephrology Dialysis Transplantation, Volume 38, Issue Supplement_1, June 2023, gfad063b_2733, https://doi.org/10.1093/ndt/gfad063b_2733
https://doi.org/10.1101/2024.11.07.24316903
Chih-Chao Yang, Pei-Hsun Sung, Ben-Chung Cheng, Yi-Chen Li, Yi-Ling Chen, Mel S. Lee, Hon-Kan Yip, Safety and efficacy of intrarenal arterial autologous CD34+ cell transfusion in patients with chronic kidney disease: A randomized, open-label, controlled phase II clinical trial, Stem Cells Translational Medicine, Volume 9, Issue 8, August 2020, Pages 827–838, https://doi.org/10.1002/sctm.19-0409
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信