近年來,干細胞治療腎病因其修復受損組織、調節免疫反應等潛力,逐漸成為慢性腎病、急性腎損傷等腎臟疾病的新興療法。然而,干細胞來源(自體或異體)、類型(間充質干細胞、臍帶血干細胞等)及給藥途徑等因素均可能影響治療安全性。
本文基于多項臨床研究與安全性數據,系統分析不同干細胞來源在腎病治療中的安全性,并結合患者需求為臨床決策提供科學依據。

自體vs異體:不同來源的干細胞治療腎病患者的安全性有區別嗎?
一、自體干細胞:低免疫排斥,但采集風險需權衡
自體干細胞來源于患者自身(如骨髓、臍帶血),免疫排斥風險極低,但需考慮細胞質量與適用性。其安全性主要體現在以下方面:
- 免疫排斥風險極低:自體干細胞與患者免疫系統完全匹配,無需配型,排異反應發生率幾乎為零。
- 采集過程的風險與創傷:
- 骨髓來源:需通過骨髓穿刺獲取,可能引發疼痛、感染或骨髓抑制,尤其對腎功能不全患者風險更高。
- 脂肪來源:通過微創手術或脂肪抽吸獲取,創傷較小,但需依賴患者自身脂肪組織的可用性。
- 細胞活性與年齡相關性:隨著年齡增長,自體干細胞的增殖能力和分化潛能可能下降,影響治療效果。
1.1 自體造血干細胞治療慢性腎病的安全性
2022年,英國科研人員在國際知名期刊《nature》上發表了一篇關于《自體干細胞移植治療伴有慢性腎病的多發性骨髓瘤患者:一種安全有效的選擇》的臨床研究成果。本次研究我們對370名接受首次自體干細胞移植(ASCT)治療多發性骨髓瘤合并慢性腎病的患者進行了回顧性分析。

本次研究患有慢性腎病患者在24或48小時后輸注自體造血干細胞(外周血干細胞),最低CD34細胞劑量為2×106/kg。
本研究系統性驗證了自體干細胞移植在合并慢性腎臟病的多發性骨髓瘤患者中的安全性。關鍵結論如下:
安全性驗證:
- 造血功能恢復:ASCT未顯著影響中性粒細胞和血小板的植入速度及成功率,與非CKD患者無統計學差異;
- 治療相關死亡率(TRM):合并CKD患者的TRM(治療相關死亡率)與非CKD組相當,未觀察到因腎功能異常導致的額外死亡風險;
- 腎功能穩定性:即使在eGFR(估算腎小球濾過率)≤30 mL/min/1.73m2的晚期CKD患者中,移植后腎功能未進一步惡化。
生存獲益一致性:
- 總生存期(OS)與無進展生存期(PFS):無論患者eGFR是否降低,其OS和PFS均無顯著差異(P>0.05),表明CKD本身未削弱ASCT的療效;
- 與其他研究的可比性:本結論與既往針對非CKD患者的ASCT研究結果高度一致,進一步支持ASCT在該人群中的適用性。
綜上所述,自體造血干細胞移植治療慢性腎病合并多發性骨髓瘤患者是安全的,并且未觀察到嚴重不良事件。
1.2 自體骨髓間充質干細胞在活體腎移植中的誘導治療安全性
2012年,我國科研人員聯合邁阿密研究所在國際知名期刊《美國醫學雜志》上發表了一篇關于《自體間充質干細胞在活體腎移植中的誘導治療一項隨機對照試驗》的臨床研究成果。
本次研究納入了159例終末期腎病 (ESRD) 的連續患者。記錄了不良事件、生命體征、實驗室參數(血液學、臨床化學和尿液分析)、感染、2周內未能實現手術傷口的初次閉合以及手術后6個月內需要干預的淋巴囊腫的形成。

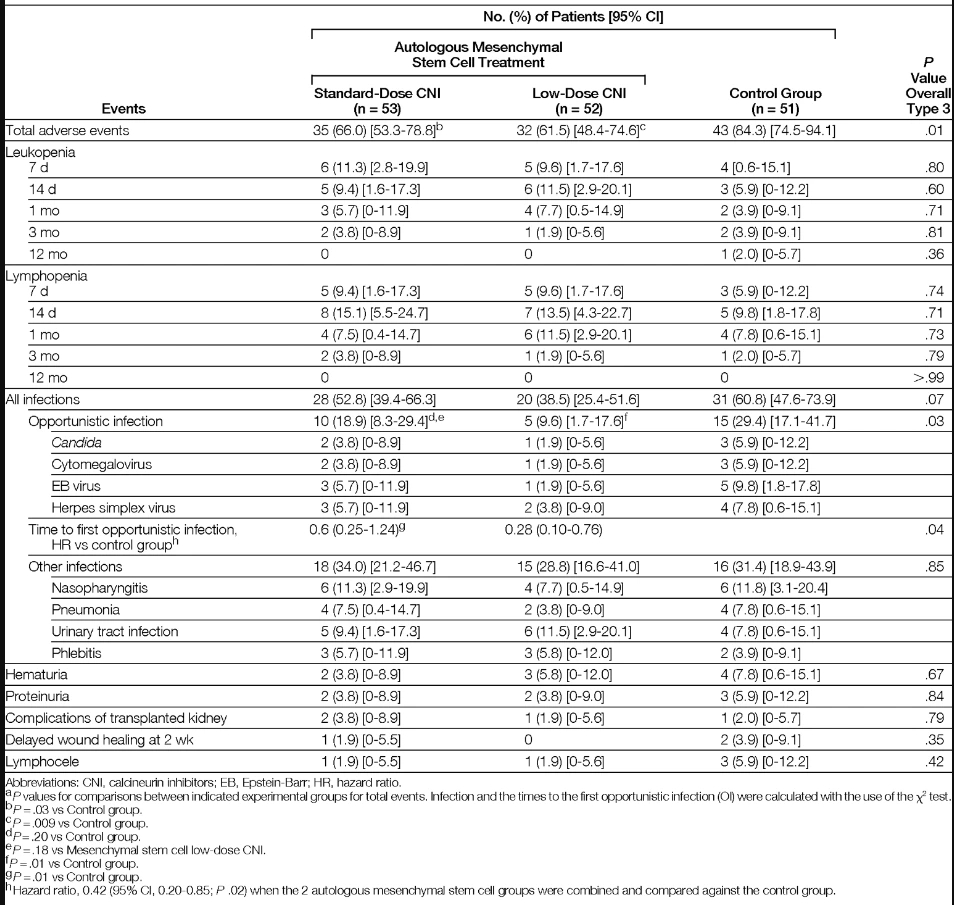
本研究結果顯示,自體間充質干細胞(MSC)治療組的總體不良事件發生率均顯著低于對照組(圖1)。具體而言:
自體間充質干細胞(MSC)治療組的總體不良事件發生率顯著低于對照組(圖1)。其中,低劑量免疫抑制劑(CNI)組機會性感染風險顯著降低(風險比0.28),而標準劑量組與對照組無顯著差異;
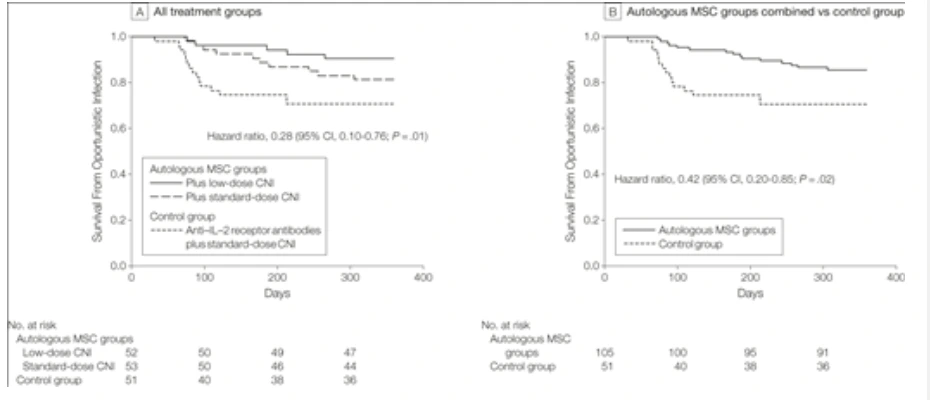
合并分析進一步表明,MSC治療組整體機會性感染風險較對照組下降58%(風險比0.42),且其他不良事件無顯著組間差異(圖1,圖2)。
二、異體干細胞:便捷高效,但需關注免疫原性
異體干細胞(如臍帶間充質干細胞、第三方脂肪干細胞)來源于他人或臍帶組織庫,其安全性取決于細胞的免疫原性及制備工藝:
- 低免疫原性與標準化生產:間充質干細胞(MSCs)表面抗原表達低,具有天然免疫調節能力,異體移植時免疫排斥風險極低。
- 無需患者自身供體,適用性廣:像臍帶MSCs取自新生兒臍帶,無需患者自身供體,避免采集創傷,且細胞增殖能力更強。
- 潛在風險與質量控制:異體干細胞需嚴格篩查供體健康狀況,避免病原體傳播(如乙肝、HIV)。此外細胞制備工藝需符合GMP標準,確保無菌、無致瘤性。
2.1 異體骨髓間充質干細胞在狼瘡性腎炎的Ⅰ期臨床中的安全性
2020年,韓國首爾漢陽大學在國際期刊《風濕病年鑒》上發表了一篇關于《同種異體骨髓間充質干細胞在狼瘡性腎炎的1期研究中的安全性 》的臨床研究成果。
這是一項針對成年狼瘡性腎炎患者的CS20AT04單臂I期劑量遞增試驗。劑量遞增采用3+3設計。起始劑量為2.0 x 106細胞/kg,若未出現劑量限制性毒性,則遞增至3.0 x 106細胞/kg。主要目的是確定最大耐受劑量,并評估輸注后28天的安全性和耐受性。

7名患者參與了這項研究。患者通過靜脈輸注接受CS20AT04治療。前3名患者的初始劑量為 2.0 x 106個細胞/kg,未出現任何劑量限制性毒性。有1名患者由于輸注過程中的技術錯誤而未接受2.0 x106個細胞/kg 的完整劑量。該患者未出現劑量限制性毒性,但另有1名患者被納入研究,使得3名患者在接受完整2.0×106個細胞/kg 劑量后才升級到下一劑量。
接下來的3名患者接受3.0×106個細胞/kg 的劑量,未出現任何劑量限制性毒性。報告了3起不良事件(1起腹瀉、1起牙痛和1起關節痛),均為NCI-CTC I級事件。
綜上所述,對于狼瘡性腎炎患者來說,單劑量高達3.0 x 106細胞/kg的異體骨髓間充質干細胞移植治療是安全的耐受性良好。
2.2 異體間充質干細胞治療糖尿病腎衰竭患者的安全性
2024年,巴基斯坦牽頭在期刊《F1000Research》上發表了一篇關于《同種異體華通氏膠間充質干細胞和外泌體療法對糖尿病腎衰竭安全有效》的病例報告。
本項研究報告了首例人類病例報告,患者為一名70歲男性,患有由2型糖尿病引起的V期慢性腎病,并接受了同種異體 hWJ-MSCs和外泌體治療。該手術包括靜脈輸注1億個干細胞和1000億個外泌體。

安全性方面,患者全程未出現任何不良反應,尤其在移植后48小時內未觀察到MSC靜脈注射常見的過敏反應(如發熱、皮疹、低血壓等),證實了同種異體華通氏膠間充質干細胞單次治療糖尿病腎病患者的安全性。并且根據實驗室結果和KDQOL-36TM問卷評估,輸注后第一至第四個月,患者的腎臟狀況顯著改善。
三、兩者安全性對比
3.1 免疫排斥與采集風險
自體干細胞(如骨髓或脂肪來源)因來源于患者自身,免疫排斥風險極低,甚至為零。但其采集過程可能帶來創傷,例如骨髓穿刺可能導致疼痛、感染或骨髓抑制(尤其對腎功能不全患者風險更高),而脂肪來源雖創傷較小,但依賴患者自身脂肪組織的可用性。
相比之下,異體干細胞(如臍帶或第三方來源)無需患者自身供體,避免了采集創傷,但需依賴供體健康篩查(如乙肝、HIV檢測)和符合GMP標準的制備工藝,以確保無病原體傳播風險。
3.2 細胞活性與年齡相關性
自體干細胞的活性和分化能力可能隨患者年齡增長而下降,影響治療效果(如老年患者的骨髓干細胞質量可能不足)。
異體干細胞(尤其是新生兒臍帶來源的MSCs)因細胞增殖能力更強且不受患者年齡影響,活性更穩定,尤其適合老年患者或供體組織不足的情況。
3.3 感染與不良事件風險
自體干細胞治療中,機會性感染風險較低。例如,自體MSC在活體腎移植中的誘導治療將感染風險降低了58%。
異體干細胞治療雖免疫排斥風險極低,但需嚴格把控供體篩查和細胞制備質量。例如,異體骨髓MSC治療狼瘡性腎炎僅出現輕微I級不良事件。
3.4 適用性與臨床選擇
自體干細胞更適合需完全避免免疫排斥的患者(如兒童或對免疫抑制劑不耐受者),但采集過程需權衡創傷風險。
異體干細胞因便捷高效,尤其適用于急需治療的終末期腎病患者或供體組織不足的患者。異體療法的標準化生產(如臍帶MSC庫)也降低了個體化制備的復雜性,但需確保供體來源的安全性。
結語
不同來源干細胞治療腎病的安全性差異顯著:自體干細胞在免疫相容性上占優,而異體間充質干細胞憑借易獲取性成為主流選擇。未來需通過規范制備流程、優化輸注策略及完善監管體系,推動干細胞治療從實驗室安全過渡至臨床普及。患者應在醫生指導下,結合病情與經濟能力,選擇風險可控的治療方案。
相關閱讀:干細胞治療腎病安全性對比:哪種類型更可靠?一文看懂
參考資料:
Lazana, I., Floro, L., Christmas, T. et al. Autologous stem cell transplantation for multiple myeloma patients with chronic kidney disease: a safe and effective option. Bone Marrow Transplant 57, 959–965 (2022). https://doi.org/10.1038/s41409-022-01657-y
Tan J, Wu W, Xu X, et al. Induction Therapy With Autologous Mesenchymal Stem Cells in Living-Related Kidney Transplants: A Randomized Controlled Trial. JAMA. 2012;307(11):1169–1177. doi:10.1001/jama.2012.316
C.B. Choi, T.Y. Lee, K.S. Kim, S.C. Bae,
AB0370?SAFETY OF CS20AT04, A HAPLOIDENTICAL ALLOGENEIC BONE MARROW-DERIVED MESENCHYMAL STEM CELLS, IN A PHASE 1 STUDY IN LUPUS NEPHRITIS,Annals of the Rheumatic Diseases,Volume 79, Supplement 1,2020,Page 1485,ISSN 0003-4967,https://doi.org/10.1136/annrheumdis-2020-eular.3287Habiba UE, Greene DL, Ahmad K et al. Case Report: Allogenic Wharton’s jelly mesenchymal stem cell and exosome therapy are safe and effective for diabetic kidney failure [version 1; peer review: 2 not approved]. F1000Research 2024, 13:379
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信