概述:自2015年以來,中國正在實施新的監管制度,對干細胞醫學實踐的翻譯進行嚴格審查。新的治理模式正在加強,以遏制未經證實的干細胞治療產品的營銷。
本文首先簡要回顧干細胞研究與發展的歷史,然后重點介紹過去幾年干細胞轉化研究的政策和國家級指南。本研究揭示了中國干細胞臨床轉化取得的主要進展和相關挑戰的幾個關鍵觀察結果。鑒于干細胞或基于干細胞的治療產品已被視為生物“藥物”,本研究將有助于更好地了解中國干細胞轉化研究的方法。

1、介紹
干細胞似乎受到廣泛關注,并且對干細胞或基于干細胞的治療產品的臨床轉化抱有很高的期望。有兩種不同類型的干細胞,胚胎干細胞 (ESC) 和成體干細胞。
胚胎干細胞是最具多能性的干細胞,主要來源于胚泡的內細胞團,胚泡是早期植入前胚胎。
成體干細胞是未分化的干細胞,存在于發育后的全身各種組織中,如骨髓、血液、骨骼肌、脂肪組織、皮膚、肝臟以及新生兒組織,如胎盤相關臍帶、羊膜和絨毛膜。從機制上講,干細胞的主要治療作用源于它們為受損/功能失調細胞的再生創造干細胞生態位微環境的能力。已經在多種疾病或醫學病癥中觀察到使用干細胞治療的益處,包括心肌病、糖尿病和糖尿病并發癥、自身免疫性疾病、骨關節炎和軟骨修復、纖維化疾病、脊髓損傷。干細胞在未來的醫學中顯示出巨大的前景。
然而,也值得注意的是,可用的臨床數據顯示干細胞應用取得了積極、消極或混合的結果。由于安全問題,臨床試驗經常失敗。例如,在之前的一項病例系列研究中,三名年齡相關性黃斑變性患者在玻璃體內注射自體脂肪組織來源的干細胞后出現了致盲性視覺結果。本研究中的一名患者(患者1)在一年的隨訪后失去了視力,因為雙眼沒有光感。因此,迄今為止,基于干細胞的藥物治療尚未建立,并且在干細胞醫學實踐的轉化方面做出了相當大的努力。

中國的干細胞研究從什么時候開始的?
中國的干細胞或干細胞相關研究可以追溯到1960年代,當時中國胚胎學家童地周開始了核移植研究。這些研究由Tong及其同事進行,旨在介紹早期發育階段的海洋物種克隆生物的細胞核轉移技術,并于1963年以中文發表在中文期刊上。此后,克隆育種技術在魚類等動物中的應用在中國迅速增加。二十年后,根據國家戰略需求,中國將通過各種科技項目發起和支持干細胞研究與開發。
早在1986年,中國就批準了國家高技術研究發展計劃(863計劃),由科技部 (MOST) 指導開發關鍵的生物、農業和制藥技術。863計劃實施以來,在我國高技術研究開發和產業化,尤其是生物技術整體研究中發揮了重要作用。
1997年,中國政府大力加強基礎研究,組織了國家重點基礎研究計劃(973計劃)。973計劃由科技部實施,重要的是,它以人為本,開展不同科學領域的基礎研究,包括生物技術研究領域。863和973計劃都在推動中國干細胞科學發展方面發揮著至關重要的作用。
2006年,中國啟動并實施了《國家中長期科技發展規劃綱要(2006-2020年)》(15年)。生物技術,包括以干細胞為基礎的人體組織工程技術,是八個前沿技術領域之一,被列為優先領域。國家自然科學最高學術機構中國科學院課題組分析了干細胞生物學和再生醫學的發展趨勢,描繪了干細胞再生醫學的宏偉藍圖,近期目標(2010-2020)、中期目標(2021-2030)、長期目標(2031-2050) 。不出所料,盡管干細胞在再生醫學領域的研發仍有諸多障礙需要克服,但前景可期。
在過去的幾年里,干細胞研發取得的進展一直推動著中國臨床轉化醫學的發展。
本論文重點介紹了引起人們關注的干細胞臨床轉化研究治理的幾個要點以及中國過去6年的主要進展。簡要回顧歷年干細胞領域政策法規的重頭戲,簡述我國為加快干細胞研發監管路徑而出現的雙軌制監管新體制2015年以來,配合政策加強監管,本研究亦為說明目前干細胞臨床研究2015年以來中國當局批準的項目以及在 clinicaltrials.gov上注冊的干細胞臨床試驗,可以代表干細胞醫學實踐轉化的現狀和進展。事實上,在2015年之前,中國還沒有衛生和藥品主管部門批準的臨床研究項目。
最后,本研究揭示了與中國干細胞醫學實踐的臨床轉化相關的最新進展和幾個關鍵觀察結果以及可操作的建議。本研究中提供的材料有助于更好地理解中國的干細胞研究和臨床轉化方法。
2、政策和影響
2015年前中國臨床干細胞研究監管規則
此前,由于缺乏明確的國家政策和干細胞治理不力,中國干細胞科學的臨床研究進展會被推遲。2003年之前,中國還沒有在ClinicalTrials.gov注冊的干細胞臨床試驗。此后,越來越多的中國干細胞臨床研究在該網站注冊。程等在中國進行了一項關于再生醫學的觀察性研究,發現從2005年到2015年,ClinicalTrials.gov上新注冊的干細胞試驗總數每年都在增加。
Kabat及其同事分析了2004年至2018年間充質干/基質細胞(MSCs)這一多能干細胞的臨床試驗趨勢,并展示了在不同國家中中國開展的臨床試驗數量最多。值得注意的是,此類干細胞的生物學特性仍存在激烈爭議,MSCs的功能定義應進一步明確。由于2015年之前中國對干細胞臨床研究和不受監管的干細胞療法的管理不善,一些診所直接向個體接受者出售未經證實的干細胞干預。
因此,中國對干細胞臨床研究和應用的管理方式經常受到社交媒體和國際科學界的批評。未經證實和未經批準的干細胞干預可能存在潛在的不安全性,并存在不可預見的風險,這威脅到干細胞臨床轉化研究的進展。未經證實的干細胞產品的商業推廣可能是一個全球性問題,不僅在中國而且在包括美國在內的許多其他國家都存在。
早些時候,中國中央政府發布了官方道德準則,人類胚胎干細胞 (ESC) 倫理指導原則,用于人類ESC研究,2003年。最近,中國出臺了各種政策/指南來規范和促進干細胞研究和臨床轉化。
2015年以來加強監管的政策
雖然干細胞研究為未來的治療提供了令人興奮的希望,但它也帶來了倫理和社會問題。2015年至2019年,國家藥品監督管理局(NMPA)(前身為國家食品藥品監督管理總局(CFDA))和中國國家衛生健康委員會(NHC)實施了一系列進步政策,以加強對干細胞轉化研究的監管。中國國家衛生和計劃生育委員會(NHFPC)(于2018年更名為 NHC)與CFDA聯合發布了《干細胞臨床研究管理指導文件》,自2015年7月20日起施行。
根據新指導意見,三甲醫院可開展干細胞臨床申請。三甲醫院通常隸屬于大學或學術機構,是中國集醫療、教學培訓和科學研究于一體的最高等級醫院。
國家衛生計生委和國家食品藥品監督管理總局還聯合成立了學術倫理委員會,為干細胞臨床研究提供技術和倫理指導。授權的三甲醫院應該有兩個委員會,這些委員會對當地的干細胞應用進行初步審查和評估。隨后,國家衛生計生委和國家食品藥品監督管理總局于2015年7月31日聯合發布了干細胞制劑質量控制及臨床前和臨床研究的指導意見草案。
2015年加強監管的指導意見要求至少30年,特別是干細胞臨床在中國的研究和應用,盡管更早的監管工作是在1993年衛生部藥品監督管理局發布人體細胞治療和基因治療臨床研究質量控制要點。
根據2015年的規定,特別值得注意的是,基于干細胞的產品、正在實施藥品準入雙軌監管體系,在單軌上,定義為上市需要的生物新藥在臨床試驗的基礎上獲得NMPA的批準。另一方面,對干細胞治療的安全有效的臨床研究支持研究性新藥或生物制劑許可申請。基于干細胞的臨床研究和干細胞治療產品批準的雙軌監管系統模型總結在圖1中。
2015年的規定和雙軌制監管機制可能為提高我國干細胞研究和臨床轉化提供新的國家戰略。然而,該草案仍存在激烈爭議,人們對2015年規定和雙軌制監管機制的一致性和穩定性感到擔憂(見下文)。
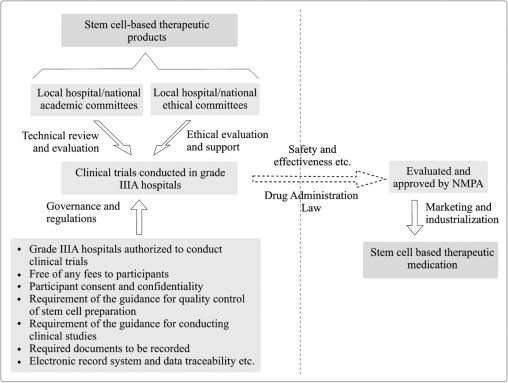
新的治理和監管模式正在加強,以遏制未經證實的干細胞治療產品的營銷。運行模式參照干細胞臨床研究和干細胞治療產品審批雙軌制監管。NMPA:國家藥品監督管理局。
隨后,中國國家衛生健康委于2019年3月29日發布了《體細胞療法臨床研究與轉化申報管理(征求意見稿)》。最新的法規草案提出,安全有效的體細胞療法可在嚴格審查下進入臨床應用。國際干細胞研究協會 (ISSCR) 擔心法規草案有可能直接向消費者提供不安全的干預措施。
因此,ISSCR于2019年5月20日向中國NMPA發送了一份聲明,要求對各種問題進行一系列評論。ISSCR表示,該法規草案與國際標準有重大差異,并建議治療用途干細胞及干細胞制品在臨床試驗完成后安全有效檢測的基礎上。例如,條例草案第10條規定允許部分醫院提供推測性干細胞干預治療疾病的安全有效檢測,在干細胞臨床研究中是有限且不充分的。因此,ISSCR建議中國根據國際準則協調其法規,以便在上市前嚴格測試安全性和有效性。目前,很少有基于干細胞的治療方法被證明是安全有效的,并在臨床上常規使用。
3、雙軌制監管政策下的干細胞臨床轉化
中國主管部門批準的干細胞臨床研究項目
2015年的法規和雙軌制監管制度被提議用于中國的干細胞臨床應用。一方面,新法規限制了提供未經證實的干細胞治療的診所。另一方面,一流的三級醫院對進入干細胞臨床實踐有嚴格的限制。2020年末全國共有三級醫院2996家,其中三甲醫院1580家。
截至2021年10月,約130家三甲醫院獲國家衛健委和國家藥監局授權開展干細胞臨床研究。本節簡要概述了六年的搜索,迄今為止已確定了總共100個臨床研究項目。這些項目在2015年法規實施后已獲得衛生和藥品主管部門的批準。這些臨床研究項目的總結如表1所示。
從表中可以看出,干細胞或干細胞衍生的治療產品用于治療各種疾病和醫學狀況,包括腦和神經系統疾病、心臟病、糖尿病、肝病、肺病、血液病、關節炎和炎癥。特別值得注意的是,在這100個臨床研究項目中,9個人類ESC相關研究正在進行中,其中3個研究是在ESCs誘導成MSCs后進行的,3個是上皮干細胞,2個是M/CAStem細胞(人ESC衍生的免疫和基質調節細胞)和1轉化為神經干細胞。



在中國clinicaltrials.gov注冊的干細胞臨床試驗
此外,為了探索中國干細胞臨床轉化研究的最新進展,本研究還對正在進行或已完成的臨床試驗進行了重要分析。本研究共列舉了自2015年法規發布以來(2015年7月20日起)在clinicaltrials.gov注冊的中國干細胞療法臨床試驗共205項,非干細胞療法除外試驗(圖2A)。在這些研究中,有129項試驗使用間充質干細胞來治療各種疾病或醫學障礙。此外,已經注冊了20項使用基于MSCs的治療產品或生物工程MSCs的試驗,包括7項使用MSCs衍生外泌體的試驗,3項使用MSCs條件培養基的試驗,以及10項使用生物材料支架技術提高干細胞治療特性的試驗。有26項臨床試驗正在使用造血干細胞定期進行。
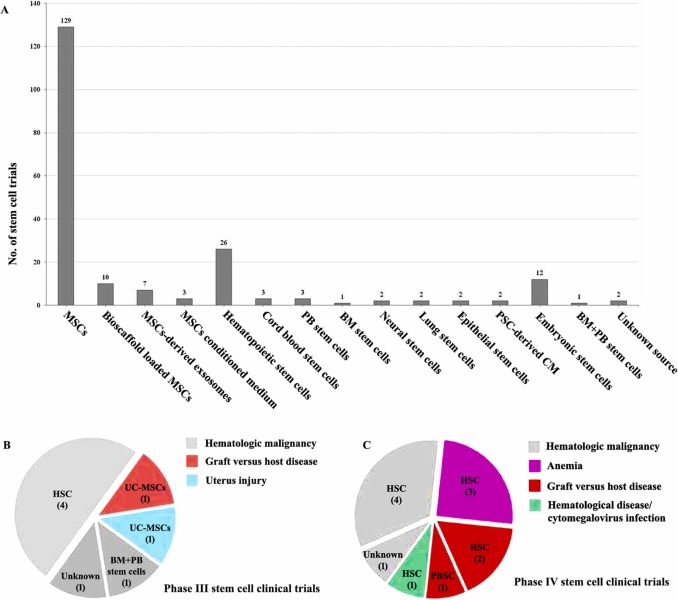
自雙軌制監管政策實施以來,中國共有205項干細胞臨床試驗在clinicaltrials.gov上注冊(A)。在這些試驗中,只有8項(3.90%)III期(B)和12項(5.85%)中國干細胞IV期(C)臨床試驗已在ClinicalTrials.gov上確定。在III期和IV期試驗中,不同類型的干細胞用于治療多種疾病或病癥。
臨床試驗通常在I-IV期進行,III期和IV期研究通常需要回答安全有效的臨床應用的重要問題。至于III期和IV期臨床試驗,只有8項(3.90%)正在進行III期(圖2B)和12項(5.85%)IV期臨床試驗(圖2C),有趣的是,大多數正在進行利用造血干細胞的III期和IV期試驗,以驗證它們在治療血液癌癥、移植物抗宿主病、貧血和其他血液疾病方面的安全性和有效性(圖2B和圖2C)。
其中,一項正在進行的 III 期試驗 (NCT05290545) 是通過使用外周血干細胞聯合骨髓干細胞治療血液惡性腫瘤進行的。正在積極研究使用臍帶來源的 MSCs 治療移植物抗宿主病的另一項III期試驗 (NCT04738981),并且正在進行另一項III期試驗 (NCT03386708) 以測試臍帶來源的MSCs的安全性和有效性用于子宮損傷的治療性修復。
clinicaltrial.gov記錄的中國人類胚胎干細胞臨床試驗
由于有關胚胎研究的關鍵科學和倫理問題,本研究強調還收集了在中國用胚胎干細胞治療疾病的臨床試驗(表2)。這些試驗是用人類胚胎干細胞衍生的細胞進行的,以治療多種疾病或醫學病癥,包括黃斑營養不良/退化、半月板損傷、帕金森氏病、卵巢功能不全、COVID-19等。事實上,中國還沒有注冊的使用胚胎干細胞的臨床試驗2015年之前在 ClinicalTrials.gov上。基本上,從臨床研究結果在clinicaltrials.gov上的公布來看,使用ESC的治療益處尚無定論。
| 識別號碼 | 地位 | 研究題目 | 細胞來源 | 疾病/狀況目標 | 治療結果 | 階段 |
|---|---|---|---|---|---|---|
| NCT02749734 | 未知 | 人胚胎干細胞來源的視網膜色素上皮細胞視網膜下移植治療黃斑變性疾病的臨床研究 | 胚胎干細胞的視網膜色素上皮細胞 | 斯塔加特黃斑營養不良 | 潛在的治療相關不良事件 | 一/二 |
| NCT02755428 | 未知 | 視網膜色素上皮細胞視網膜下移植治療老年性黃斑變性病 | 來自胚胎干細胞的視網膜色素上皮 | 干性年齡相關性黃斑變性 | 一年隨訪時的安全性和耐受性 | 一/二 |
| NCT03046407 | 未知 | 人胚胎干細胞來源的視網膜色素上皮治療干性年齡相關性黃斑變性病 | 來自胚胎干細胞的視網膜色素上皮 | 干性年齡相關性黃斑變性 | 一年隨訪時的安全性和耐受性 | 一/二 |
| NCT03119636 | 未知 | 人胚胎干細胞來源的神經前體細胞治療帕金森病的安全性和有效性研究 | 來自胚胎干細胞的神經前體細胞 | 帕金森病 | 潛在的治療相關不良事件 | 一/二 |
| NCT03839238 | 未知 | hESC衍生的MSC樣細胞治療半月板損傷的安全性觀察 | 源自ESC的MSC樣細胞 | 半月板損傷 | 潛在的治療相關不良事件 | 一/二 |
| NCT03877471 | 主動,不招人 | 原發性卵巢功能不全女性間充質干細胞樣細胞移植 | 源自ESC的MSC | 原發性卵巢功能不全 | 不適用 | 我 |
| NCT03944239 | 未知 | 臨床人胚胎干細胞來源的視網膜色素上皮細胞視網膜下移植治療色素性視網膜炎的安全性和有效性 | 胚胎干細胞的視網膜色素上皮細胞 | 視網膜色素變性 | 潛在的治療相關不良事件 | 我 |
| NCT03973021 | 取消 | 非常小的胚胎樣干細胞治療勃起功能障礙 | 非常小的類胚胎干細胞 | 器質性勃起功能障礙 | 不適用 | 一/二 |
| NCT03975101 | 取消 | 非常小的胚胎樣干細胞治療膝骨關節炎 | 非常小的類胚胎干細胞 | 膝關節骨性關節炎 | 不適用 | 一/二 |
| NCT03976206 | 取消 | 用于面部皮膚抗衰老的極小胚胎樣干細胞 | 非常小的類胚胎干細胞 | 皮膚炎癥 | 不適用 | 一/二 |
| NCT03985462 | 取消 | 用于卵巢的非常小的胚胎樣干細胞 | 非常小的類胚胎干細胞 | 卵巢早衰 | 不適用 | 一/二 |
| NCT04331613 | 未知 | CAStem 治療伴有/不伴有 ARDS 的嚴重 COVID-19 的安全性和有效性 | 人類胚胎干細胞衍生的M細胞 (CAStem) | 有或沒有 ARDS 的嚴重 COVID-19 | 治療相關不良事件 | 一/二 |
干細胞治療COVID-19的臨床試驗
干細胞在緊急時刻對COVID-19的管理產生了臨床興趣。已經探索了干細胞或干細胞衍生的治療產品來對抗新型傳染病。中國有11項臨床試驗在clinicaltrials.gov上注冊,使用不同的干細胞來源治療COVID-19(表3)。其中,鑒于間充質干細胞的旁分泌活性和免疫調節功能等獨特的治療特性,進行了10項臨床試驗以測試MSC或MSC衍生的治療產品(MSC 衍生的外泌體)在治療COVID-19患者中的安全性和有效性。同時,有一項試驗通過使用人類ESC衍生的免疫和基質調節細胞來控制疾病。目前,從NIH PubMed.gov收集到的中國已發表的干細胞干預臨床研究只有9篇(表4)。值得注意的是,從臨床研究中收集的臨床數據不足以支持干細胞管理對COVID-19患者的強大益處。
| 識別號碼 | 招聘情況 | 研究題目 | 治療劑 | 狀況/疾病 | 狀態/階段 | 參與人數 |
|---|---|---|---|---|---|---|
| NCT04371601 | 主動,不招人 | 間充質干細胞治療2019新型冠狀病毒肺炎的安全性和有效性 | 間充質干細胞 | COVID-19肺炎 | 1 | 60 |
| NCT04346368 | 尚未招聘 | 骨髓間充質干細胞治療2019冠狀病毒病 (COVID-19) 重癥患者 | 骨髓間充質干細胞 | 新冠肺炎 | 1/2 | 20 |
| NCT04339660 | 招聘中 | 人間充質干細胞治療COVID-19肺炎的臨床研究 | UC-間充質干細胞 | 新冠肺炎 | 1/2 | 30 |
| NCT04336254 | 招聘中 | 同種異體人牙髓間充質干細胞治療重癥COVID-19患者的安全性和有效性研究 | 同種異體人牙髓干細胞 | 新冠肺炎 | 1/2 | 20 |
| NCT04331613 | 未知 | CAStem 治療伴有/不伴有ARDS的嚴重 COVID-19的安全性和有效性 | 鑄鐵 | COVID-19/急性呼吸窘迫綜合征 | 1/2 | 9 |
| NCT04293692 | 取消 | 2019新型冠狀病毒感染的肺炎患者的治療 | UC-間充質干細胞 | 新冠肺炎 | 不適用 | 0 |
| NCT04288102 | 完全的 | 用人臍帶來源的間充質干細胞治療嚴重的冠狀病毒病2019 (COVID-19) | UC-間充質干細胞 | 新冠肺炎 | 2 | 100 |
| NCT04276987 | 完全的 | 間充質干細胞外泌體吸入治療重癥新型冠狀病毒肺炎的初步臨床研究 | MSCs衍生的外泌體 | 新冠肺炎 | 1 | 24 |
| NCT04273646 | 尚未招聘 | 人臍帶間充質干細胞治療重癥COVID-19的研究 | UC-間充質干細胞 | 新冠肺炎 | 不適用 | 48 |
| NCT04269525 | 招聘中 | 臍帶 (UC) 來源的間充質干細胞 (MSC) 治療2019新型冠狀病毒 (nCOV) 肺炎 | UC-間充質干細胞 | 新冠肺炎 | 2 | 16 |
| NCT04252118 | 招聘中 | 間充質干細胞治療感染COVID-19的肺炎患者 | 間充質干細胞 | 新冠肺炎 | 1 | 20 |
| 疾病/狀況 | 干細胞來源 | 給藥途徑 | 學習類別 | 治療效果 | 參考 |
|---|---|---|---|---|---|
| 嚴重的COVID-19 | UC-間充質干細胞 | 靜脈輸液 | 試點和對照研究 | 安全性和有效性 | [42] |
| 中度和重度 COVID-19 | UC-間充質干細胞 | 靜脈輸液 | 第一階段 | 安全和耐受 | [43] |
| 嚴重的COVID-19 | UC-間充質干細胞 | 靜脈輸液 | 第三階段 | 安全且可能有效 | [44] |
| 嚴重的COVID-19 | 牙髓干細胞 | 靜脈輸液 | I/II 期協議 | 不適用 | [45] |
| 嚴重的COVID-19 | MB-MSCs | 靜脈輸液 | 第一階段 | 死亡率顯著降低,MSCs 組死亡率為 7.69%,對照組為 33.33% | [46] |
| 嚴重的COVID-19 | UC-間充質干細胞 | 靜脈輸液 | 二期 | 一年隨訪時臨床改善 | [47] |
| COVID-19伴肺纖維化 | hESC-IMRCs | 靜脈輸液 | 第一階段 | 安全性和臨床癥狀的改善 | [48] |
| 嚴重的COVID-19 | hWJC | 靜脈輸液 | 案例報告 | 改善臨床癥狀 | [49] |
| COVID-19肺炎 | 間充質干細胞 | 靜脈輸液 | 試點案例系列研究 | COVID-19肺炎的改善 | [50] |
如上所述,此處提供作為原材料的數據,以便更好地了解中國正在進行的干細胞臨床轉化和產業化方法(見下文)。一般而言,盡管過去幾年在該領域做出了臨床努力,但干細胞的治療益處目前尚無法獲得。
4、增加干細胞研發資金
繼續了解干細胞研究這一快速發展領域的政策法規和進展,本研究已擴展到分析中國政府對干細胞研究和開發的資金支持。863和973計劃都為支持我國干細胞研究和發展奠定了堅實的科技基礎。
國家自然科學基金委(NSFC)對干細胞研究和臨床應用的投入從2000年到2014年逐年增加,這可能會加速干細胞研發的進程。國家自然科學基金是此類工作的主要國家資金來源。
1997-2019年,國家自然科學基金資助8050個干細胞項目,耗資37億元人民幣(約合5.76億美元)。中國于2014年設立的國家重點研發計劃(NKPs)特別關注關鍵和戰略技術,并在三到五年的研究期內支持社會福利和民生領域的研發。2016年和2017年的年度電話會議中,包括干細胞研發在內的NKP共計42項。
為緊跟監管政策要求,近十年來,國家通過“五年規劃”等多種渠道,加速向干細胞科學及應用領域投入大量資金,以引導國家社會經濟發展。此前,中國在2011年至2015年的“十二五”期間對干細胞研究的投資約為30億元人民幣(約合4.35億美元)。
繼上一個五年計劃之后,2016-2020年的“十三五”計劃重點關注海洋學、腦科學和干細胞等研究領域。在第十三個五年計劃期間,中國有一個名為“干細胞和轉化研究”的計劃,在干細胞研究和開發方面的預算約為30億元人民幣(約合4.35億美元)。
中國政府將在“十四五”期間(2021-2025年)將基礎研究投入提高到研發總支出的8%左右。我們認為,在2021年至2025年的當前五年計劃中,干細胞研究經費投入將大幅增加。
| 資助組織或計劃 | 時間或創立時期 | 資助金額(百萬美元) |
|---|---|---|
| 國家自然科學基金委 | 1997–2019 | 約576個(支持8050個干細胞項目) |
| 十二五規劃 | 2011–2015 | 約435 |
| 十三五規劃 | 2016–2020 | 約435 |
| “十四五”規劃 | 2021–2025 | 約占研發總支出的8% |
5、我國干細胞轉化研究的主要進展與成果
近年來,中國干細胞轉化研究取得了長足的進步。中國在具有高度科學和臨床意義的領域取得的主要進展如下所述。
首先,組織工程和新型干細胞技術的應用表明了干細胞療法的發展。例如,如上所述,干細胞臨床研究正在探索源自MSC的外泌體和條件培養基以及用作支架的生物材料。理論上,由于干細胞的大小,MSCs的物理特性可能對干細胞輸注體內后的遷移和植入有嚴格的限制,從而影響其治療效果。外泌體和條件培養基含有多種治療分子從MSCs中獲得的外泌體和條件培養基的應用可以避免細胞相關的問題。眾所周知,生物材料支架方法可以改善干細胞(例如 MSC)的治療特性。
其次,為增強中國的國際競爭力,中國政府實施了多項優惠政策,吸引海外知名科學家參與該領域的國際合作,吸引海外華人人才回流。例如,近十年來,國家級的海外精英人才計劃在中國不斷發展,如萬人計劃、新百人計劃、青年長江學者計劃等。海外科學家和海歸作為新的動力源,在國際科技合作中發揮著重要作用,以產生更具影響力的干細胞研究。
三是國內在該領域創建的優質干細胞研究中心和一流實驗室越來越多。同樣,一大批干細胞公司也在中國迅速成立。比如,目前中國大城市周邊有很多干細胞庫,這些干細胞庫公司未來會涉足干細胞產業。這些研究實驗室和公司聚集了該領域的許多國家級科學家和干細胞界的海外精英。中國科學家和海歸不遺余力地在該領域開展高水平活動,為干細胞臨床轉化和產業化發揮了重要作用。
第四,過去幾年中國研究和科學家對國際出版物的貢獻顯著增加。
根據美國科學信息研究所的數據,2000-2019年,中國在全球科學期刊中基礎、臨床前和臨床研究的發表數量(56913篇)排名第二。然而,關于中國研究出版物的質量仍然存在爭議。
第五,隨著科學技術的進步,中國已經發展了自己的干細胞技術,例如在胚胎干細胞領域。如上所述,在撰寫本文時,在中國注冊的臨床試驗有12項涉及人類ESC研究,而全球同一領域的試驗有33項(https://clinicaltrials.gov/)。
截至2019年6月,我國ESCs領域專利申請9292件,授權246件。由于中國創建的ESCs線越來越多,2020年,中國修訂了《專利審查指南》與人類胚胎干細胞的可專利性相關,它明確定義了在受精后14天內使用人類胚胎干細胞衍生的人類胚胎的發明或創造,無需體內和體外發育。
最后,還提到了我國在干細胞研究領域取得的進步成就,并舉幾個有代表性的例子進一步說明了這一重要問題。中國科學院曾在媒體上報道,科學家和醫生利用人臍帶間充質干細胞成功修復了中國女性受損的卵巢,并幫助她生下了一個健康的寶寶。通過干細胞治療修復生殖器官,或將給不孕女性帶來新的希望。
此外,中國科學院中國國家干細胞資源中心 (NSCRC) 成立于2007年,是多能干細胞研究領域的國際合作伙伴。NSCRC現在已經儲備了400多個人類胚胎干細胞系用于基礎和轉化研究。此外,人造組織或類器官工程是與干細胞相關的一個新領域,在中國的再生醫學領域正在發展。2011年至2019年,國家自然科學基金已在中國資助了45個與肝、腦、腸、心、子宮、卵巢、腎和肺等不同器官相關的類器官項目。表6總結了中國在該領域取得的主要進展和成就。
| 干細胞研發的科學領域 | 主要進展和成就的一些例子 |
|---|---|
| 先進的干細胞技術 | (1)組織工程在干細胞轉化研究(例如,被視為支架或細胞表面工程的新型生物材料)和人造組織或類器官工程中的應用(2)在該領域獲得更多專利許可(例如,人類胚胎干細胞的可專利性)(3)基因組編輯和干細胞改造等。 |
| 國際合作 | (1)吸引海外科學家合作和華僑華人回國政策(2)胚胎干細胞領域的國際合作 |
| 基礎設施項目和干細胞設施 | (1)更多優質干細胞研究中心和領域內打造的頂級實驗室(2)眾多干細胞庫(3)用于轉化研究的胚胎干細胞系制備和儲備資源中心 |
| 創新的干細胞療法 | (1)具有先進干細胞技術的新興創新干細胞療法(2)改進的治療方法,例如外泌體和條件培養基衍生干細胞(例如 MSC)的應用,以及在干細胞臨床研究中用作支架的生物材料 |
| 國際科學貢獻 | (1)發表的干細胞科學論文的年增長率(2)ESCs領域的國際合作等 |
| 研發人員 | 中國科學家和海歸 |
| 增加資金和注冊臨床研究的數量 | (1)研發資金的增長和支持的眾多項目(2)廣泛的疾病或醫療條件的臨床研究顯著增加 |
盡管人們熱切希望有一天能夠以干細胞為基礎,安全有效地治療各種人類疾病和醫療狀況,但由于干細胞在體內功能特性的不確定性,中國轉化干細胞臨床研究的主要進展緩慢輸液后。盡管該領域已取得長足進展,但該領域尚未取得重大突破,為實現中國的宏偉目標,干細胞研發仍面臨諸多挑戰。
6、討論
如前所述,近年來中國在干細胞轉化研究和干細胞或基于干細胞的治療產品的產業化方面沒有取得重大進展。轉化率很低,盡管目前正在努力在眾多臨床前和臨床研究中測試干細胞或基于干細胞的產品的安全性和有效性。在歡迎中國在該領域取得進展的同時,本文也強調了未來干細胞臨床轉化、市場化和產業化的幾個重要問題。
實行雙軌制監管政策
人們擔心當前的治理模式能否在未來遏制提供未經證實的干細胞干預的診所。一個關鍵問題是當地醫院和衛生當局是否有責任遏制干細胞產品的營銷或在其所在地區進行干預。當地醫院學術和倫理委員會應作為顧問,幫助更好地了解國家干細胞臨床研究管理的監管方法和政策。地方衛生部門在執行國家監管政策方面面臨挑戰。因此,需要注意2015年法規的一致性和穩定性,以及雙軌制監管機制,加強對轉化干細胞臨床研究的監管。
根據國際協議要求適時進行嚴格監管
鑒于干細胞研究的嚴格管理要求,一些臨床醫生和干細胞研究人員也擔心我國目前的治理模式是否會限制干細胞臨床研究和創新。一些人提出,中國可以采取更靈活的方式來加速干細胞治療嚴重疾病的發展,例如,對末期患者進行不受監管的干細胞干預的監管豁免。隨著該領域的快速發展,應及時修訂強有力的法規,以支持基于國際指南(如ISSCR指南)的干細胞臨床轉化。
例如,如上所述,中國修改了《專利審查指南》2020年重新考慮人類ESC相關發現的可專利性,明確了人類胚胎干細胞在任何發育階段都不屬于人體。未來,需要考慮監管問題,例如基因組編輯、干細胞修飾、線粒體替代、類器官和將干細胞工程化為功能組織。對于干細胞研究和產業化的全球戰略,迫切需要將中國規范的干細胞政策與國際標準方案相協調。為縮小中國與西方國家之間的差距,最重要的是,中國臨床醫生和進行治療臨床研究的研究人員以及政府管理者應就干細胞相關爭議問題加強國際有效溝通。
立法限制基于干細胞的臨床研究
中國以往的干細胞醫學實踐表明,在細胞療法領域對違規行為進行處罰是必不可少的。雖然中國一直在對干細胞臨床轉化實施嚴格管理,即雙軌監管政策,但中國仍然缺乏專門針對干細胞使用的法律授權。這是我國干細胞干預管理反復調整的主要原因。
目前,干細胞或基于干細胞的治療產品在中國已被視為生物“藥物”,但干細胞存在于合法性的灰色地帶。因此,相關立法對明確轉化干細胞或干細胞相關研究勢在必行,盡管干細胞干預受制于中國藥品監督管理法。這將有助于加強中國干細胞臨床研究、市場化和產業化的國家監管水平。沒有干細胞的法律地位,警告和懲罰似乎被忽視,未經證實的干細胞治療的市場將繼續增長。
例如,一名年輕女士在一家不受道德準則監管的干細胞診所使用未經證實的干細胞美容產品治療后面部受損。這場悲劇在2022年中央電視臺“3.15秀”中被揭露,這是一個中國國有電視節目,旨在保護消費者權益。診所提供未經批準的基于干細胞的產品,將客戶置于危險之中,這表明存在需要通過立法進一步克服的機械障礙。
培訓參與干細胞干預的醫生和其他臨床醫生
醫生在干細胞的臨床轉化中起著重要作用。然而,中國三甲醫院開展干細胞試驗的一些醫生對干細胞的了解不足,無法評估干細胞產品或干預措施對個體接受者的安全性和有效性。這些提供干細胞干預的醫學博士(包括住院醫師和研究員)中的大多數都沒有在中國接受過干細胞培訓的經驗。需要對干細胞干預的管理程序、倫理和公眾關注、推進干細胞知識和技術進行特殊培訓。
分享從臨床前和臨床結果中獲得的準確科學信息
關于未經證實的干細胞產品和干預措施的在線非法廣告數量,中國的一個混亂現象仍然令人擔憂。患者或消費者可能因虛假和夸大的說法而產生誤導。通常,一些患者可能急于求醫而求助于干細胞干預。中國的一些醫生和研究人員有時會不恰當地夸大干細胞或干細胞衍生產品的潛在治療效果,而沒有透露實際益處和實際風險的事實。
事實上,干細胞的治療益處主要依賴于體外和體內研究。移植患者的長期和短期安全性和有效性的臨床數據仍然缺乏。及時交流準確的信息,無論是正面的還是負面的,對于干細胞臨床轉化的研發至關重要。通常,臨床試驗的負面數據可能不會公開報告,因此,對基于干細胞的干預措施的透明度仍然存在地方或全球倫理問題。相應地,存在與干細胞干預相關的經濟利益沖突的醫生和研究人員應在其進行的臨床研究中披露任何經濟關系。
7、結論
在過去的幾年里,中國的干細胞臨床轉化研究正在慢慢平行推進,以了解干細胞的治療特性。可以想象,與幾年前在中國診所銷售的不安全、無效的實驗性細胞療法相比,中國在臨床干細胞研究和應用方面取得了監管進展。事實上,未經證實的干細胞干預措施的營銷近年來可能會大大減少。目前,除常規的造血干細胞外,干細胞或基于干細胞的治療產品作為生物新藥在中國尚無NMPA批準上市。
過去六年,中國在干細胞領域還沒有新的、令人矚目的技術突破。中國的干細胞臨床轉化仍面臨諸多挑戰。使用干細胞作為臨床常規治療選擇需要仔細評估,這仍然是一個難以實現的目標。轉化干細胞臨床研究的未來既充滿希望又充滿挑戰。
雖然干細胞臨床研究引起了倫理和公眾的關注,但在中國缺乏營銷條件的情況下,似乎可以看出當前監管方式的力度。希望在接下來的幾年里,監管機制能夠繼續在進行轉化干細胞臨床研究中發揮關鍵作用。這項研究強調了干細胞臨床研究是如何通過雙軌監管政策進行監管的。實施更嚴格的監管制度,以促進未來的干細胞研究,以增加循證生物醫學。重要的一步是朝著干細胞研究的全球標準邁進,盡管中國的干細胞研究和臨床轉化還需要克服許多障礙。
【主要參考文獻】
Chenghai Li,Strengthening regulations, recent advances and remaining barriers in stem cell clinical translation in China: 2015–2021 in review,Pharmacological Research,Volume 182,2022,106304,ISSN 1043-6618,
https://doi.org/10.1016/j.phrs.2022.106304.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信