銀屑病是一種由免疫介導、慢性、復發性、炎癥性、全身性疾病,由個體與環境相互作用而誘發,且由于治療難度較大,往往伴隨終身疾病。近年來,包括生物制劑在內的多種靶向治療手段雖然改善了大多數銀屑病患者的皮損和生活質量,但仍未能解決復發問題,且可能隨著時間的推移導致療效下降或出現感染等不良事件。因此,銀屑病治療亟需突破,延緩復發及非藥物治療策略,而干細胞治療銀屑病應運而生。近年來,干細胞治療銀屑病的研究備受關注,但目前尚無可參考的標準和共識。
湘雅領銜發表國際首部指導干細胞在銀屑病治療領域中的共識
近日,由中南大學湘雅醫院皮膚科牽頭的“Expert consensus on the application of stem cells in psoriasis research and clinical trials (干細胞在銀屑病研究領域和臨床試驗的專家共識)”在國際雜志《Aging and disease》在線發表。

該共識為國際首部指導干細胞在銀屑病治療領域中的共識。
中南大學湘雅醫院陳翔教授、中國醫學科學院基礎醫學研究所趙春華教授擔任通訊作者,中南大學湘雅醫院匡葉紅教授為第一作者、與張謐主治醫師為共同執筆人。
該共識明確了銀屑病治療常用的干細胞類型、干細胞治療銀屑病的方法、劑量和途徑,以及干細胞治療銀屑病的臨床評價。此外,此共識還規范了干細胞及其相關產品的采集、制備、保存和質量控制過程,為銀屑病干細胞治療領域提供了最新的具體參考標準和實踐指南。
1、對干細胞研究機構開展研究治療疾病試驗的要求有什么?
干細胞研究通用規則
干細胞可源自胚胎或成體組織,具備自我更新和分化潛能,可分為自體或異體類型,并支持體外分離傳代及新鮮/凍存儲存。
干細胞研究規范:臨床前與臨床研究執行準則
臨床前研究:需制定嚴謹方案,確保記錄完整可追溯。細胞質量須符合臨床應用標準(優質且純凈),生產流程須遵守GMP規范。須開展基因組穩定性、致瘤性、異常分化等生物學分析,動物實驗遵循”減少、優化、替代”三原則。有效性研究需模擬臨床條件、設置充分對照、隨機盲法設計,并建立量效關系;安全性研究需監測細胞體內分布、異常分化及長期毒副作用。
臨床研究:須以充分科學依據為基礎,權衡受試者與公眾的健康收益與風險(收益須大于潛在危害),保障受試者權益。根據ISSCR指南,所有干細胞干預臨床應用須經獨立倫理委員會前瞻性審查批準。研究方案需經獨立專家評估(涵蓋臨床前數據、統計方法及受試者保護),結束后需長期隨訪監測治療安全性與有效性。
干細胞制劑制備機構管理規范:設施、質控與人員體系要求
硬件設施:須配備萬級(局部百級)潔凈度的GMP車間,布局符合藥品GMP標準,每臺儀器配備標準操作規程(SOP)。
質量管理:建立符合GMP的完整質量管理體系,設立獨立質管部門承擔質量保證(QA)與質量控制(QC)職能,并基于產品特性與工藝進行風險評估。
人員與設備:指定專人負責制備管理、質量管理及質量監督;建立人員設備檔案,提供專業培訓(含安全防護、應急預案及繼續教育);定期校準維護設備以保障生產質量。
2、治療銀屑病常用的干細胞類型有哪些?
2.1、脂肪間充質干細胞
ADMSCs于1973年首次在脂肪組織中發現,2001年由Zuk正式命名。其可通過高效的膠原酶消化法從脂肪組織中分離,產量高且操作簡便。ADMSCs具有多向分化潛能及組織修復功能。
2016年,De Jesus團隊報道2例銀屑病患者接受自體ADMSCs輸注后,PASI評分顯著下降(分別從21.6降至8.9、24降至8.3),癥狀緩解最長持續292天,但其中1例關節炎癥狀未改善。
2023年,Amir團隊對5名患者進行皮損內注射,6個月觀察期所有患者皮損輕至顯著改善,且無嚴重不良反應,證實ADMSCs治療安全性。
2.2、臍帶間充質干細胞
UCMSCs源自臍帶華通膠及血管周圍組織,21世紀初被報道。其分離主要采用組織塊貼壁法或酶消化法,具有增殖力強、免疫原性低、來源倫理風險小(取自醫療廢棄物)等優勢。
臨床證據表明:2022年,中南大學基礎醫學院生殖與干細胞工程研究所進行了一項為期1/2a的單臂臨床試驗,17名銀屑病患者接受了UCMSC輸注。治療后,47.1%的患者的PASI評分改善至少40%,17.6%的患者的醫生整體評估(PGA)評分(醫生用來評估患者病情總體嚴重程度的指標)提示皮損已消退或基本消退;治療期間及隨后的6個月隨訪中均未見明顯副作用。
Chen等[10]報道,使用UCMSC治療2名尋常型銀屑病患者后,皮損消失,且四五年內無復發。
2.3、真皮來源的間充質干細胞
DDMSCs是存在于真皮層的主要間充質干細胞,體外呈成纖維細胞樣形態增殖,可通過組織塊法或酶消化法分離,具有來源豐富、增殖力強的特性。
Campanati研究發現:將健康供體的DDMSCs(H-MSCs)與銀屑病患者的DDMSCs(PsO-MSCs)共培養,可顯著改善PsO-MSCs的炎癥表型,表明DDMSCs在調節銀屑病病理過程中具有重要治療潛力。
| 作者 | 來源 | 地點 | 年 |
|---|---|---|---|
| 薩赫 | 臍帶 | 韓國 | 2016 |
| 六戶 | 胖的 | 日本 | 2016 |
| 李 | 臍帶 | 韓國 | 2017 |
| 金 | 扁桃體 | 韓國 | 2018 |
| 坎帕納蒂 | 真皮 | 意大利 | 2018 |
| 陳 | 臍帶 | 中國 | 2019 |
| 今井 | 羊膜 | 日本 | 2019 |
| 金 | 胚胎 | 韓國 | 2019 |
| 孟 | 紙漿 | 中國 | 2021 |
| 張 | 胚胎 | 新加坡 | 2021 |
| 陳 | 臍帶 | 中國 | 2022 |
| 葉 | 牙齦 | 中國 | 2022 |
| 張 | 臍帶 | 中國 | 2022 |
| 張 | 臍帶 | 中國 | 2022 |
| 魯 | 臍帶 | 中國 | 2022 |
| 丁 | 臍帶 | 中國 | 2022 |
| 任 | 臍帶 | 中國 | 2023 |
| 溫 | 紙漿 | 中國 | 2023 |
| 卡里略 | 臍帶 | 智利 | 2023 |
| 王 | 臍帶 | 中國 | 2023 |
2.4、牙齦間充質干細胞(GMSCs)
GMSCs提取自牙齦固有層組織,具有抑制炎癥和免疫調節功能,長期培養仍能保持形態穩定和端粒酶活性。其倫理風險低、獲取便捷、分化潛能突出,被視為優質間充質干細胞來源。Ye等通過咪喹莫特誘導的銀屑病小鼠模型證實,GMSCs輸注可通過降低Th1/Th17相關細胞因子顯著緩解皮膚炎癥。
Wang團隊報道1例19歲重度斑塊狀銀屑病患者(既往多種治療失敗),經5次異體GMSCs注射后皮損完全消退,隨訪3年無復發且無不良反應。
2.5、牙髓間充質干細胞(DPSCs)
DPSCs存在于人牙髓組織中,具備強增殖力、多向分化能力和免疫調節特性。Wen等研究發現,在銀屑病模型小鼠皮下注射DPSCs可有效減輕皮損癥狀,并顯著抑制表皮異常增殖標志物(角蛋白16、S100A8/A9)的表達,證實其治療銀屑病的臨床潛力。
2.6、羊膜間充質干細胞(AMSCs)
AMSCs源自胎盤羊膜層,屬高分化潛能的圍產期干細胞。分離時需先釋放羊膜上皮細胞,再經膠原酶消化獲取。其特點包括:
- 形態為短梭形貼壁細胞,可穩定傳代至30代
- 獲取率高、增殖速度快,供體年齡不影響細胞活性
- 異體應用免疫原性低,排斥風險小
- 適合大規模標準化生產
Imai等動物實驗表明AMSCs能抑制銀屑病皮炎進展并減輕角質細胞炎癥反應,但尚缺臨床研究證據。
2.7、扁桃體間充質干細胞(TDMSCs)
TDMSCs從人扁桃體組織中分離(常來源于扁桃體切除手術廢棄物),具有標準MSCs的增殖與分化能力。Kim團隊通過銀屑病小鼠模型證實其有效抑制皮炎炎癥,但因缺乏臨床研究,現階段主要價值在于原料易得性及治療潛力探索。
2.8、骨髓造血干細胞
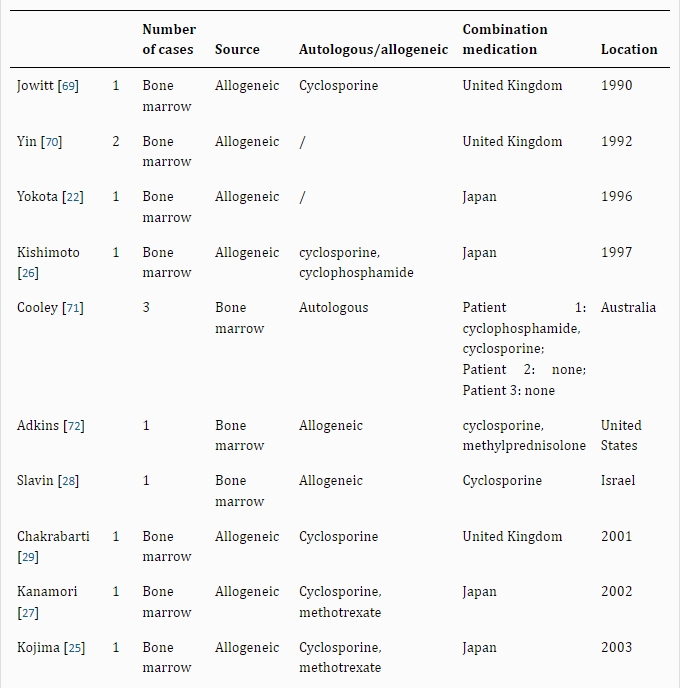
生物學特性與臨床應用:骨髓造血干細胞(BMHSCs)具備強大的自我更新與多向分化能力,可生成各類免疫細胞祖細胞,是外周免疫細胞的主要來源。通過免疫磁珠法或流式細胞術可從骨髓中分離BMHSCs。其移植分為自體與異體兩類,其中異體移植因復發率顯著低于自體移植,已成為銀屑病(尤其合并血液疾病患者)的重要治療手段。
臨床證據與療效:多項病例研究證實異體BMHSC移植對銀屑病合并血液疾病具有雙重療效。橫田、居萊爾等學者報道的案例顯示,合并再生障礙性貧血的銀屑病患者移植后皮損完全消退且貧血緩解;小島、岸本等研究則證明其對急性髓系白血病合并銀屑病患者同樣有效(移植后皮損消退且白血病無復發)。此外,針對慢性髓系白血病、淋巴瘤(NHL)及膿皰型銀屑病的案例也觀察到銀屑病與血液病的同步長期緩解,最長隨訪達2年無復發。
研究現狀與局限:BMHSCs是目前治療銀屑病歷史最久、病例積累最多的干細胞類型,其療效數據支持度優于其他干細胞(如臍帶間充質干細胞僅17例研究)。然而,不同干細胞療法之間尚無直接對比研究,限制了對最優治療策略的評估(見表2)。現有證據凸顯了BMHSCs在難治性銀屑病(尤其合并血液疾病)中的臨床潛力,但需進一步對照研究明確其比較優勢。

3. 干細胞治療牛皮癬的科學基礎
疾病機制與干細胞異常:銀屑病的核心發病機制涉及免疫系統失調,包括樹突狀細胞異常激活Th1/Th17通路、促炎-抗炎因子失衡及角質形成細胞過度增殖形成的炎癥循環。關鍵證據表明,患者皮損處的間充質干細胞呈現功能異常:促血管生成能力增強,而免疫抑制與抗氧化能力減弱,且分泌譜向促炎狀態偏移,提示異常干細胞可能通過多重機制參與疾病進展。
干細胞療法的多元作用機制:不同來源干細胞通過特異性途徑干預銀屑病進程。研究最深入的臍帶間充質干細胞(UCMSCs)可顯著降低IFN-γ、TNF-α等核心炎性因子,減少致病性Th1/Th17細胞,并通過抑制中性粒細胞浸潤及調節MMP13通路抑制角質增生。脂肪、骨髓等其他來源干細胞同樣能下調炎癥因子并抑制角質細胞增殖(如通過上調TGF-β),而真皮與牙髓干細胞則分別依賴PD-L1通路調控Th17反應或通過調節T細胞亞群平衡(如降低Th17/Treg比值)發揮作用。
治療潛力的共性基礎:盡管干細胞來源各異,其治療銀屑病的科學基礎均指向三大核心機制:抑制異常免疫細胞(如T細胞亞群)的增殖分化、阻斷關鍵促炎因子表達級聯、直接干預角質形成細胞病理性增殖。這些共性作用機制為干細胞療法奠定了堅實的理論基礎,凸顯其在重塑銀屑病免疫微環境中的廣闊前景。
4. 干細胞及相關產品制備的機構要求
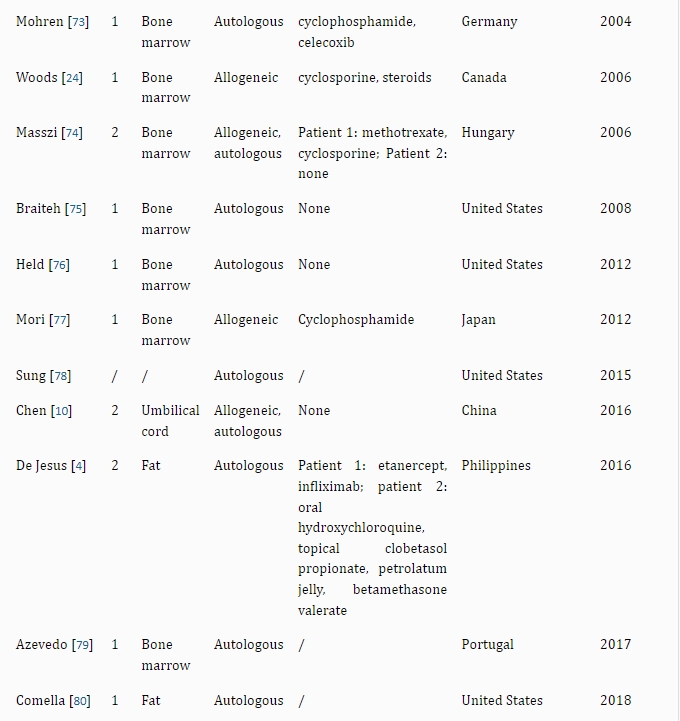
機構干細胞產品制備涉及生物醫藥、倫理、法律法規等多個領域,核心要求如下。
4.1 道德與合規
研究人員應當對干細胞研究進行倫理審查,確保符合《涉及人類的生物醫學研究倫理審查辦法》,干細胞的來源和獲取過程應符合倫理道德。
4.2 質量管理
- 干細胞的制備需要建立質量控制和保證體系,包括細胞表征、無菌技術和環境監測。
- 制劑生產應遵循GMP及相關規定,建立完整的質量管理體系。
- 機構必須進行風險評估,合理設計工作區域,確保各職能區域獨立且滿足要求。
- 控制微生物、微粒及熱原污染風險。
- 管理、質量控制人員必須具備相關專業知識和經驗,且不得兼職。所有相關人員均須接受專業培訓。
- 人員應及時報告可能的污染并采取措施避免污染。
- 必須保證設備、儀器的可追溯性,并按照使用說明書的要求進行管理。
- 如果使用電子信息系統,機構應建立并驗證相關的管理程序。
4.3 知識產權
在考慮干細胞領域的創新和發明時,應關注知識產權,例如專利保護。
5. 干細胞采集、制備、儲存和質量控制
標準化采集與分類檢測:干細胞采集需在GMP規范下建立嚴格的操作與管理流程。自體干細胞(未經復雜體外操作)需進行基礎檢測,包括細胞活力、增殖能力、外源性病原微生物及基本特性鑒定;而異體干細胞(經復雜體外操作)還需增加內源性病原微生物篩查、特性深度分析及細胞純度檢測,確保源頭安全性與功能性。
精細化制備與微環境適應:干細胞制備涵蓋分離、純化、擴增、定向分化等全鏈條環節,每個步驟均需制定獨立SOP并定期更新。針對移植后病理微環境(如缺氧、炎癥因子)的挑戰,研究強調通過”預處理”提升干細胞適應性:例如用TNF-α預激活可增強MSCs在氧化應激下的增殖與存活能力,利用疾病相關刺激物優化干細胞功能已成為提升療效的關鍵策略。
差異化凍存保障細胞活性:穩定儲存是臨床應用的核心前提。基于不同類型干細胞的低溫生物學特性差異(如抗凍損傷能力),需定制最優凍存方案。低溫凍存技術不僅保障運輸與長期儲存可行性,更通過個性化凍存方法維持細胞解凍后的活性與功能,為治療有效性提供底層支撐。
雙軌質控與全周期穩定性管理:質量控制分為質量檢驗(全面評估安全性、有效性及質量)和放行檢驗(批制備后快速檢測)。前者覆蓋細胞特性、無菌性、致瘤性等21項檢測;后者依據前者定制簡化標準。此外,需在臨床前/臨床階段持續進行穩定性研究(包括儲存期、運輸后狀態),通過評估活力、純度等參數確定保存液配方、運輸條件及有效期,構建全生命周期質控體系。
6. 干細胞治療銀屑病的方法、劑量和途徑
目前,國內外現有的用于治療銀屑病的干細胞療法主要有BMHSC靜脈輸注、ADMSC靜脈輸注或皮下注射、UCMSC靜脈輸注、GMSC靜脈輸注(圖1)。
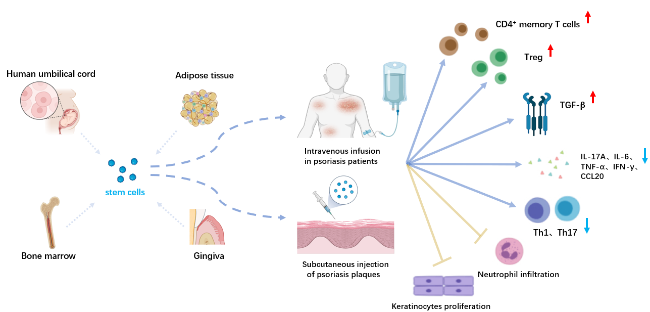
干細胞治療銀屑病的劑量和途徑
BMHSCs的個體化給藥特點:骨髓造血干細胞(BMHSCs)目前缺乏統一治療方案,臨床多用于銀屑病合并血液病患者。主要采用靜脈輸注,劑量跨度大(CD34+細胞0.5×10?至2.5×10?細胞/kg),或單次輸注總量高達4×10?細胞/kg。關鍵操作包括輸注前使用抗組胺藥物預防過敏反應,凸顯其方案的高度個體化特征。
ADMSCs的雙途徑精準干預:脂肪源性間充質干細胞(ADMSCs)具備靜脈與皮下注射雙途徑方案:靜脈輸注推薦0.5~3×10?細胞/kg(每4周1次,共2~3次);皮下注射則根據皮損面積精準給藥(單點1×10?細胞或3×10?細胞/cm2),實現局部病灶的靶向治療。
UCMSCs與GMSCs的差異化方案:臍帶間充質干細胞(UCMSCs)靜脈輸注方案最復雜,含三種劑量-周期組合(如1.5~2×10?細胞/kg每2周1次,或2.5~3×10?細胞/kg每4周1次),部分需分階段追加輸注。牙齦間充質干細胞(GMSCs)因臨床數據稀缺,暫定劑量為3×10?細胞/kg(每周2次),5周后可啟動第二療程。
輸注規范與標準化挑戰:所有靜脈輸注均需遵循嚴格操作流程:混勻細胞懸液、使用輸血過濾器、控制初始滴速(20-30滴/分鐘)及生理鹽水沖管。當前不同干細胞因來源與給藥途徑差異導致療效參差,尚無標準化方案。未來需深入探索最佳劑量、療程及給藥策略,以提升治療可重復性與安全性。
7. 干細胞輸注治療牛皮癬的管理:調理、監測和不良反應的處理
預處理:治療當天,應將干細胞解凍并準備注射。每批干細胞在移植前都應經過放行檢驗。注射前應將干細胞懸浮于5mL生理鹽水中[14]。局部注射時,干細胞以3×106細胞/mL的密度重懸于0.9%生理鹽水中。靜脈輸注時,干細胞以1×106細胞/mL的密度重懸于0.9%生理鹽水中[43]。
目前,尚無關于干細胞預處理治療銀屑病的臨床研究。在現有的干細胞治療銀屑病的臨床試驗中,為防止不良反應的發生,通常在輸注前肌肉注射抗組胺藥,如苯海拉明。對于使用干細胞治療銀屑病,需要進一步研究預處理方案,所采用的各種方法和組合需要進一步優化。
監控:輸液過程中應密切監測患者呼吸、脈搏、血壓、血氧飽和度的變化,做好急救措施。少數患者可能出現一過性胸悶、發熱等不適癥狀,一般可自行緩解。如癥狀持續或嚴重,應停止治療,監測生命體征、完成心電圖等檢查,并采取吸氧等必要的急救措施。
不良反應處理:綜合Stem Cell Reports發表的治療其他疾病的研究及治療銀屑病的臨床研究資料和病例報告,臨床應用中未觀察到嚴重不良事件。
報道的安全性事件主要為低熱、胸悶、頭暈、輕微腹痛、心電圖異常、咽炎等[?9,45],一般在24小時內消退。個別患者可出現高熱,可給予物理降溫及對癥藥物治療。另外,不排除發生輸液反應、過敏性休克的可能,一旦出現應積極對癥治療。
8. 干細胞治療牛皮癬的臨床評價(療效及安全性)
臨床研究中,常采用PASI評分評估治療前后皮損嚴重程度。PASI評分是對皮損面積、紅斑、鱗屑及厚度程度的綜合評估。主要評估部位為頭部、軀干、上肢和下肢。PASI 75表示治療后PASI評分與基線相比改善75%,PASI 90、PASI 100等分別表示改善90%、100%等。
綜合目前已發表的關于干細胞治療銀屑病領域的臨床研究和病例報告,治療可分為治療期、緩解期和復發期三個時間窗。
治療期間,有2項臨床研究以PASI評分改善率作為主要評價指標,1份病例報告評估了治療期間PASI評分絕對值的變化。在評估皮損改善的同時,可以從醫患雙方的角度同時評估治療后PGA、皮膚病生活質量指數(DLQI)和瘙癢數值評定量表(INRS)評分的變化趨勢。
在緩解期,銀屑病患者的皮損逐漸消退,多項研究報道,銀屑病患者經干細胞治療后皮損完全消退,即PASI100反應率。此外,有3項研究證實干細胞治療后銀屑病皮損基本消退,即達到PASI 90緩解率或PGA 0/1評分。
雖然既往研究證實了干細胞治療的有效性,但也有不少研究注意到了干細胞治療后的復發問題,觀察時間窗為2至5年不等。對于復發的定義,目前公認的標準為PASI評分改善≤基線PASI評分的50%,復發時間為停止治療至PASI改善率降低50%的時間。
因此,評價干細胞治療銀屑病的療效時,建議治療期間以PASI改善率或PASI絕對值評分作為主要評價指標,緩解期以PASI 75/90/100作為主要評價指標。對于長期觀察的患者,應關注復發情況及中位復發時間。鑒于銀屑病是一種全身性疾病,建議使用銀屑病關節炎疾病活動評分 (PASDAS) 和整體患者評估等工具來評估患者的整體狀況。
9.干細胞衍生物應用研究
干細胞衍生物是干細胞釋放或分泌到細胞外基質中的活性成分,包括干細胞培養基(CM)和細胞外囊泡(EVs)。干細胞培養基含有干細胞分泌的蛋白質、microRNA、生長因子、抗氧化劑等活性物質。干細胞EVs包括外泌體、微泡、凋亡小體等。現有與銀屑病治療相關的EVs研究主要以外泌體為主。
Seetharaman[54]等將ADMSC衍生條件培養基(ADMSC-CM)局部應用于銀屑病皮損,每天一次,持續一個月,治療了一名38歲的尋常型銀屑病患者。患者的PASI評分從28分降至0分,生活質量改善,且無不良反應。
雖然干細胞衍生物尚未廣泛應用于臨床研究,但與干細胞相比,干細胞衍生物具有以下特點:
- (1)更易于儲存和運輸;
- (2)作為非細胞生物療法,倫理問題較少;
- (3)非自我復制,避免了致癌風險;
- (4)免疫原性和致敏性較低,比干細胞更安全。
這些特點提示干細胞衍生物在銀屑病治療方面具有巨大的潛力。
10. 結論與展望
干細胞作為人體中具有多種分化潛能和免疫調節功能的細胞,多年來一直被研究作為銀屑病治療的選擇,其潛在機制也不斷被研究,有望成為銀屑病治療的新方法。
不同類型的干細胞已被發現通過調節銀屑病皮損中免疫細胞的浸潤和炎癥因子的水平來糾正不平衡的免疫反應,改善銀屑病的臨床癥狀。干細胞衍生物,如干細胞分泌的生長因子和外泌體,是一種非細胞治療方法,具有獲取方便、性質穩定、易于保存、倫理問題較少等應用優勢,因此有在臨床上推廣的潛力。此外,干細胞與藥物、中藥、小分子化合物相結合的方法也在研究之中。例如,有研究表明,中藥成分槲皮素在治療類風濕關節炎中可以促進UCMSCs的抗炎作用。
因此,可以優化各種方法的組合,以最大程度地發揮干細胞治療銀屑病的治療效果。值得注意的是,在干細胞技術的商業化過程中,與專利權和知識產權相關的復雜挑戰需要特別注意。盡管干細胞研發帶來了創新的治療方法,但在保護專利、確保技術轉讓的公平性和遵守道德標準之間找到平衡是研究機構和商業實體必須解決的關鍵問題。
總之,作為治療銀屑病的新興方法,干細胞及其衍生物具有巨大的未來應用潛力。
參考資料:Ye-Hong Kuang , Wu Zhu , Ge Lin , La-Mei Cheng , Qun Qin , Zhi-Jun Huang , Yu-Ling Shi , Chun-Lei Zhang , Jin-Hua Xu , Ke-Xiang Yan , Cheng-Zhi Lv , Wei Li , Qin Han , Ilia Stambler , Lee Wei Lim , Sasanka Chakrabarti , Brun Ulfhake , Kyung-Jin Min , Georgina Ellison-Hughes , William C Cho , Kunlin Jin , Danni Yao , Chuanjian Lu , Robert Chunhua Zhao , Xiang Chen. Expert Consensus on the Application of Stem Cells in Psoriasis Research and Clinical Trials. Aging and disease. 2024 https://doi.org/10.14336/AD.2024.0012
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信