中國首款干細胞藥品的上市叩開了再生醫學產業化大門,緊隨其后的密集受理浪潮正推動中國邁入細胞治療的黃金時代。
歷史性突破與臨床落地
2025年1月2日,國家藥監局通過優先審評審批程序附條件批準鉑生卓越生物科技的艾米邁托賽注射液上市,成為我國首個獲批的干細胞治療藥品,用于治療激素治療失敗的急性移植物抗宿主病(aGVHD)。時隔5個月,北京大學人民醫院黃曉軍院士團隊于2025年6月5日開出國內首張該藥處方,標志著干細胞藥品正式實現臨床轉化。

產業進入高速發展期
截至2025年5月31日,國內累計160項干細胞新藥獲得臨床試驗默示許可。適應癥范圍不斷擴展,從血液系統疾病延伸至呼吸系統、心血管系統及自身免疫系統疾病。
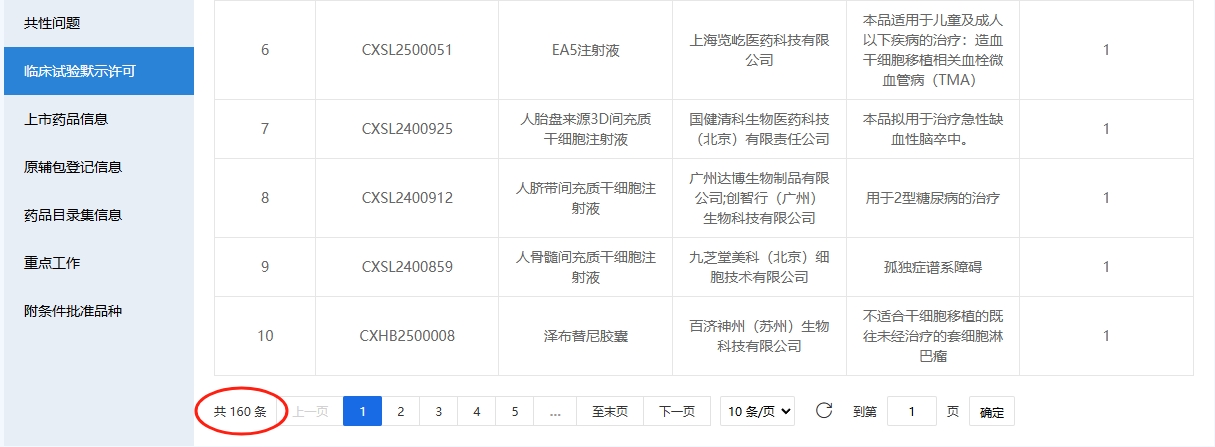
僅2025年1-5月,藥監局便受理了13項干細胞藥物臨床試驗申請,其中12項為間充質干細胞新藥,1項為造血干細胞新藥,平均每月近3項的受理速度凸顯行業創新活力。
01:2025年1-5月干細胞新藥受理分析
間充質干細胞:主導地位穩固
2025年前五個月受理的12項間充質干細胞新藥中,臍帶來源的間充質干細胞產品占比超過50%,成為最受研發企業青睞的細胞來源。
- 臍帶來源占比50%(6項)
- 脂肪/牙囊/羊膜/宮血等新型來源占比50%(6項)
適應癥覆蓋骨關節炎(41.7%)、呼吸系統疾病(25%)、生殖系統疾病(16.7%)三大領域,其中膝骨關節炎成為最熱門方向(4項)。顯示出間充質干細胞在多種疾病治療中的潛力。
造血干細胞:持續深耕血液疾病領域
唯一受理的造血干細胞新藥——瑞風生物“HBG基因修飾自體CD34+造血干細胞注射液”(CXSB2500048),聚焦輸血依賴型β-地中海貧血,延續該技術路線在血液疾病治療中的優勢。隨著移植年齡限制放寬(歐美>65歲患者占比18.8%),臨床適用人群正持續擴大。
02:2025年1-5月受理的13項干細胞藥物臨床試驗申請詳細
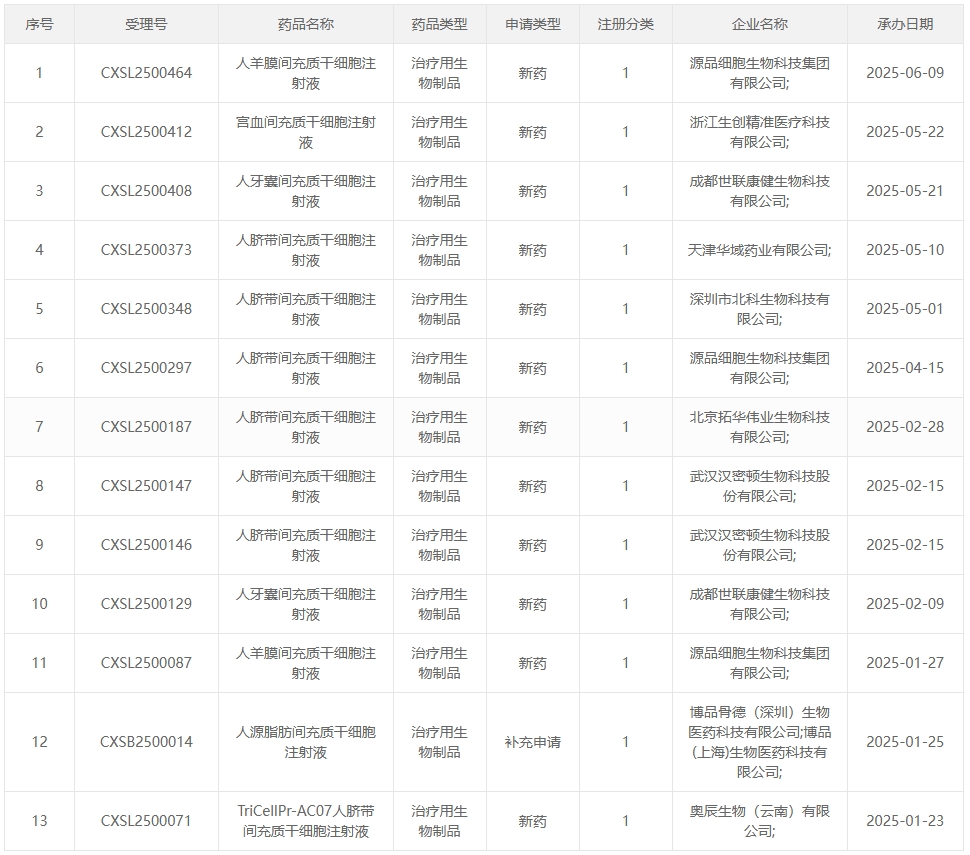
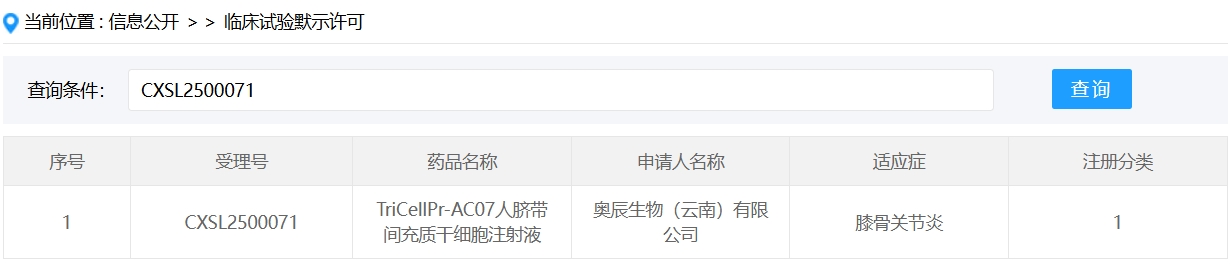
新增受理1:2025年1月23日,奧辰生物(云南)有限公司申報的 “TriCellPr-AC07人臍帶間充質干細胞注射液” 臨床試驗申請首次獲受理(受理號:CXSL2500071),適應癥:膝骨關節炎。
新增受理2:2025年1月25日,博品骨德(深圳)生物醫藥科技有限公司;博品(上海)生物醫藥科技有限公司的“人源脂肪間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2200162),這是該款細胞注射液第1次獲得受理,適應癥:膝關節炎。

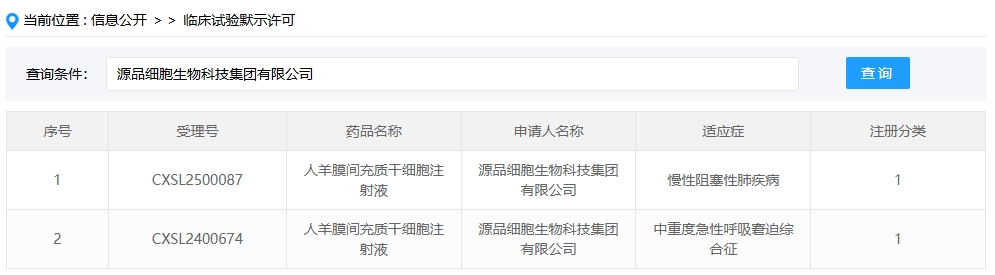
新增受理3:2025年1月27號,源品細胞生物科技集團有限公司的“人羊膜間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500087)。這是該款細胞注射液第2次獲得受理,適應癥:慢性阻塞性肺疾病。
第2次是在2024年09月28號,獲得人羊膜間充質干細胞注射液對中重度急性呼吸窘迫綜合征進行臨床試驗的默許(受理號:CXSL2400674)。適應癥:中重度急性呼吸窘迫綜合征。
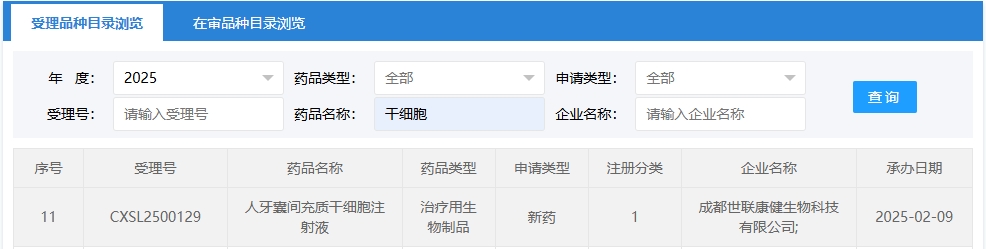
新增受理4:2025年02月09號,成都世聯康健生物科技有限公司的“人牙囊間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500129)。這是該款細胞注射液第2次獲得受理。
新增受理5:2025年02月15號,武漢漢密頓生物科技股份有限公司的“人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500146)。適應癥:卵巢早衰(無生育需求)。
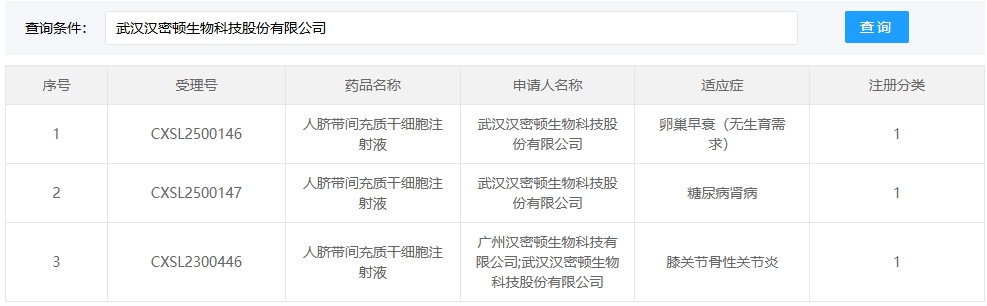
新增受理6:同一天該款細胞注射液同時獲得受理(受理號:CXSL2500147)。適應癥:糖尿病腎病。
這是該細胞注射液第3次獲得受理。此前,該款細胞注射液已于2023年獲準默許進入臨床試驗(受理號:CXSL2300446),適應癥:膝關節骨性關節炎。
新增受理7:2025年02月28號,北京拓華偉業生物科技有限公司的“人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500187)。適應癥:纖維化性間質性肺病。
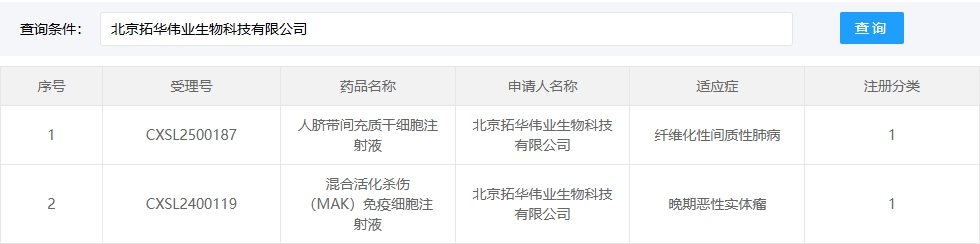
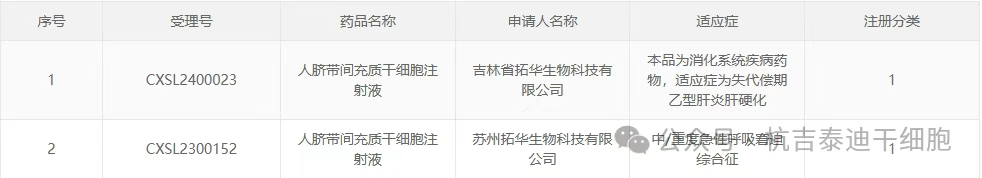
此前,其關聯公司的“人臍帶間充質干細胞注射液”已獲準默許進入臨床試驗:
- (1)企業名稱:蘇州拓華生物科技有限公司;受理年度:2023年;受理號:CXSL2300152;適應癥:中/重度急性呼吸窘迫綜合征。
- (2)企業名稱:吉林省拓華生物科技有限公司;受理年度:2024年;受理號:CXSL2400023;適應癥:失代償期乙型肝炎肝硬化。
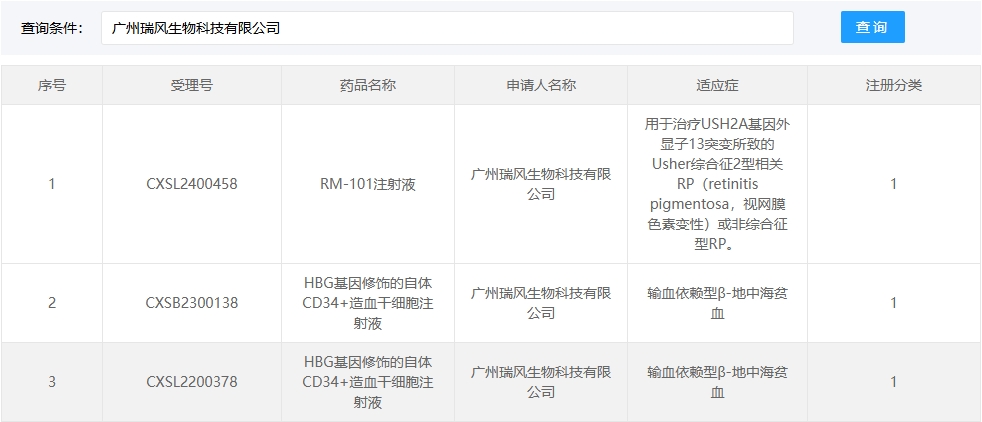
新增受理8:2025年4月15號,廣州瑞風生物科技有限公司的“HBG基因修飾的自體CD34+造血干細胞注射液”的臨床試驗申請獲受理(受理號:CXSB2500048)。適應癥:輸血依賴型β-地中海貧血。
新增受理9:2025年04月15號,源品細胞生物科技集團有限公司的“人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500297)。這是該款細胞注射液第1次獲得受理。

另外,源品細胞生物科技的“人羊膜間充質干細胞注射液”于2025年1月27日新增慢性阻塞性肺疾病適應癥(受理號:CXSL2500087)。
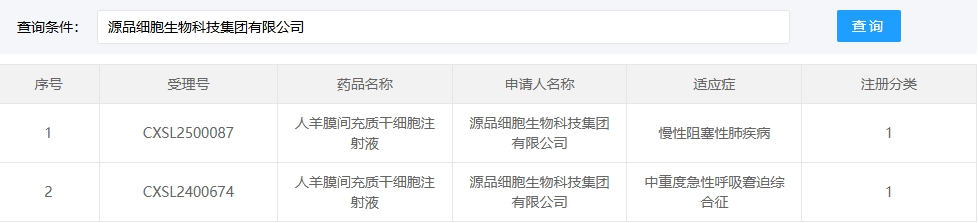
此前該產品已獲批中重度急性呼吸窘迫綜合征適應癥(2024年9月,CXSL2400674),實現同一藥物覆蓋呼吸系統兩大重癥領域。
新增受理10:2025年05月01號,深圳市北科生物科技有限公司的“人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2400092)。這是該款細胞注射液第1次獲得受理。適應癥:中重度系統性紅斑狼瘡。

新增受理11:2025年05月10號,天津華域藥業有限公司的“人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500373)。這是該款細胞注射液第1次獲得受理。

新增受理12:2025年05月21號,成都世聯康健生物科技有限公司的“人牙囊間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500408)。這是該款細胞注射液第1次獲得受理。

新增受理13:2025年05月22號,浙江生創精準醫療科技有限公司的“宮血間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500412)。這是該款細胞注射液第3次獲得受理。

早前,2021年03月03號,該細胞注射液通過獲準默許進入臨床試驗(受理號:CXSL2101001)。適應癥:特發性肺纖維化。
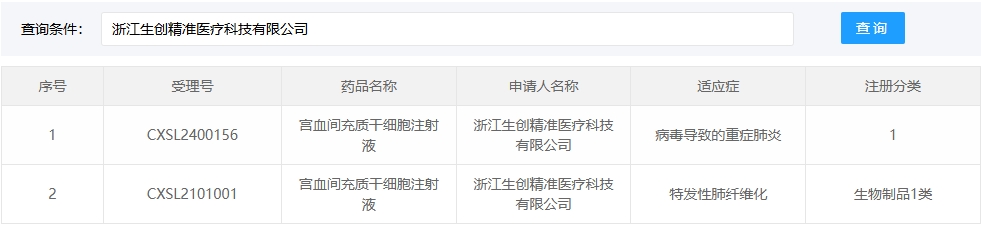
2024年2月,該款細胞注射液獲準默許進入臨床試驗(受理號:CXSL2400156)。適應證:病毒導致的重癥肺炎。
03 中國干細胞產業的黃金十年啟幕
技術突破與臨床價值雙輪驅動:2025年5月,吉美瑞生全球首創的腎干細胞新藥(REGEND003)獲批臨床,通過尿液無創提取SOX9+CD73+腎前體細胞,為2型糖尿病腎病提供再生醫學新方案。

此類顛覆性技術創新,正推動干細胞療法從血液疾病向代謝性疾病、退行性病變等重大慢性病領域縱深發展。
政策與產業生態協同進化:隨著海南率先落地干細胞臨床治療定價機制,商業保險覆蓋范圍逐步擴大,患者支付瓶頸逐步破解。160項臨床試驗默示許可的背后,是藥品審評中心(CDE)建立“默示許可60天”快速通道、地方政府配套產業園區等系統性支撐的結果。
從跟跑到領跑的戰略轉型:當黃曉軍院士開出首張干細胞藥物處方時,中國再生醫學已跨越從實驗室到臨床的最后一道鴻溝。
未來十年,隨著iPSC技術、基因編輯干細胞等前沿方向持續突破,中國有望在神經修復、器官再生等領域實現全球引領。這160項臨床試驗,不僅是科學探索的里程碑,更是中國為人類對抗重大疾病提供的“細胞級”解決方案。
寫在最后:干細胞治療的終極目標正在改寫醫學范式——從延緩疾病進展到實現組織再生,從對癥治療到根治性治愈。在這場關乎人類健康的科技競逐中,中國第一次站在與全球并跑的起跑線上。
主要參考資料:CDE,圖源CDE官網截圖。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信