一支透明液體緩緩注入患者靜脈,中國干細胞藥物的商業化時代就此開啟。
干細胞新藥正式進醫院!19800元一針,到底能治什么病?哪些人將最先受益?
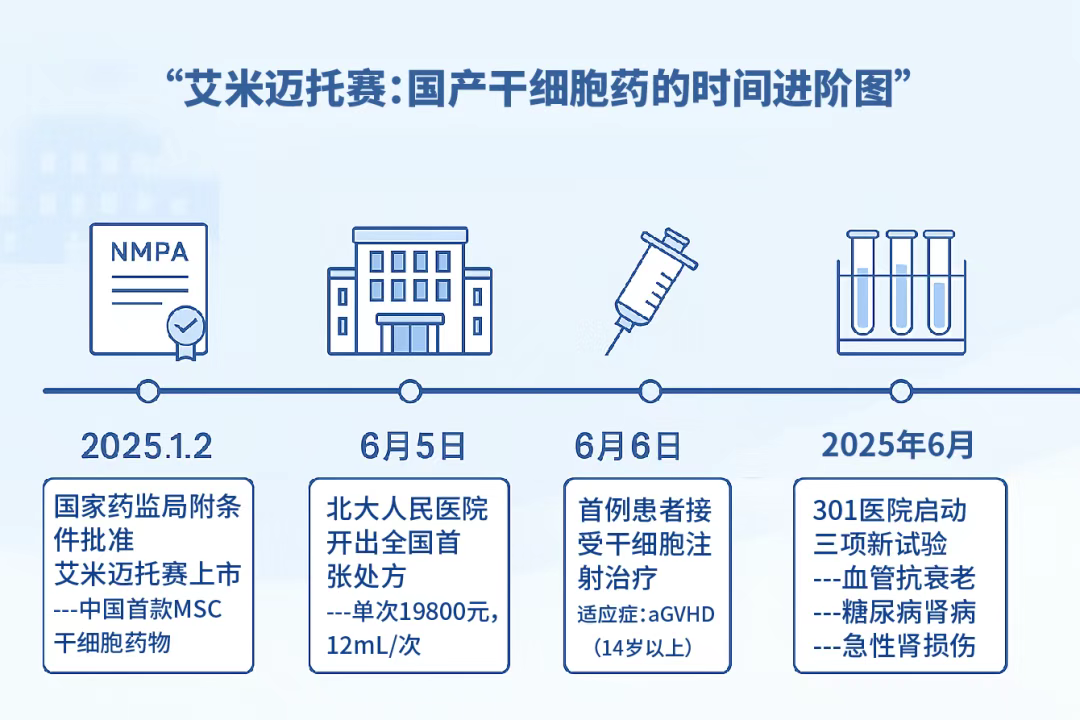
2025年6月5日,北京大學人民醫院血液科診室,黃曉軍院士簽發了中國首張干細胞藥物處方——艾米邁托賽注射液(商品名:睿鉑生)。24小時后,這支承載著生命希望的藥劑,通過專業冷鏈運輸跨越半個北京城,于6月6日13時32分精準注入一位單倍體移植患者的體內。

這標志著我國自主研發的干細胞藥物正式開啟商業化臨床應用,從實驗室研究邁向普惠醫療的新紀元。
“首張處方落地不僅是一次商業銷售,更是干細胞治療技術從科研成果向臨床可及治療的突破性跨越。”鉑生卓越生物科技研發負責人表示。這款定價19800元/針的“中國智造”,正在改寫全球干細胞治療的天價規則。
一、歷史性突破:首款干細胞藥的誕生之路
國家藥監局2025年1月2日通過優先審評審批程序,附條件批準了這款國產干細胞新藥上市,用于治療14歲以上消化道受累為主的激素治療失敗的急性移植物抗宿主病(aGVHD)。作為國內首個獲批上市的干細胞治療藥品,睿鉑生從研發到上市歷經了12年的科學攻堅。
早在2013年3月,該藥物就提交了IND(研究性新藥申請),卻直至2020年6月才啟動首次臨床試驗公示。2024年6月,國家藥監局藥品審評中心將其納入優先審評審批程序,同年6月25日正式提交NDA(新藥上市申請),最終在2025年初獲批。
國家藥監局藥品審評中心副主任王濤透露:“自2017年至今,我國已有超過120款干細胞治療產品獲批進入臨床試驗階段,適應癥覆蓋血液系統、呼吸系統、心血管系統以及自身免疫性疾病。”
二、破解致命困境:aGVHD患者的生死博弈
對普通人而言陌生的“急性移植物抗宿主病”,卻是數萬造血干細胞移植患者的噩夢。這種疾病是異基因造血干細胞移植后,來源于供者的淋巴細胞攻擊受者組織發生的?多器官綜合征,主要累及皮膚、胃腸道、肝、肺和黏膜表面,引發嚴重組織炎癥和纖維化。
“在睿鉑生上市前,國內缺乏專門針對耐藥性aGVHD的干細胞藥物,治療主要依靠免疫抑制劑,但這些藥物療效有限且副作用明顯。”一位華東地區臨床專家向21世紀經濟報道記者解釋。
傳統治療面臨三重困境:
- 高發生率:每年我國約2萬例造血干細胞移植患者中,30%-50%會發生aGVHD
- 激素抵抗:約30%-40%患者對一線糖皮質激素治療無反應
- 死亡威脅:重度aGVHD患者死亡率高達80%
這款源自人臍帶間充質干細胞的新藥,通過其獨特的免疫調節功能,為這些陷入絕境的患者點亮了新的治療曙光。
03、國產首款干細胞藥破圈!301醫院啟動血管抗衰、腎病三大臨床,招募進行中
1. 適應癥拓展:從罕見病邁向廣闊天地
關注行業動態的您可能已留意到,中國人民解放軍總醫院(301醫院)近期啟動了三項以艾米邁托賽注射液為核心的新臨床試驗。這標志著這款國產首創的間充質干細胞藥物,正將其應用潛力從獲批的罕見適應癥——激素難治性急性移植物抗宿主病(aGVHD),系統性地探索至更普遍的疾病領域:血管衰老、糖尿病腎病以及急性腎損傷。目前,這些具有重要臨床意義的研究項目已面向社會公開招募受試者。
2. 聚焦三大戰場:研究目標與設計
這三項研究各有側重:
對抗血管衰老:評估艾米邁托賽在改善血管內皮功能、延緩動脈硬化進程方面的效果,目標是助力健康老齡化。研究計劃招募140名受試者,接受4-7次靜脈輸注治療。
守護腎臟健康(糖尿病腎病):探究該藥物是否能通過顯著降低蛋白尿、改善關鍵腎功能指標,為糖尿病患者提供長期的腎臟保護。
阻擊急性腎損傷:針對住院危重患者,研究干細胞治療對促進急性腎損傷后腎功能快速恢復的作用及其安全性。此類疾病進展迅猛,亟需有效干預手段。

3. 科學選點的深層邏輯:機制與臨床需求的精準匹配
301醫院選擇這三大方向絕非偶然,而是基于堅實的科學機制與迫切的臨床需求:
核心機制契合:間充質干細胞(MSC)公認的核心作用機制之一是?“抗炎 + 促血管生成”。這意味著它們既能調節有害的炎癥微環境,又能刺激產生如VEGF(血管內皮生長因子)等關鍵因子,促進新生血管形成。這一雙重特性,使其天然成為應對血管功能退化(衰老)?和腎臟微循環障礙(腎病)?的理想候選者。
急性腎損傷的獨特優勢:急性腎損傷(AKI)病情兇險、進展快速,現有治療手段有限且效果常不理想。然而,正因為其病程短、變化快,在臨床試驗中反而更容易在相對短時間內觀察到干細胞治療是否產生明確、可衡量的積極效果,為驗證藥物有效性提供了高效的“窗口”。
四、如何理性看待這款全新干細胞藥物?
01、療效:聚焦明確適應癥,填補臨床空白
精準靶向難治性疾病:該藥獲批適應癥為激素治療失敗的急性移植物抗宿主病(aGVHD)——這是造血干細胞移植后由供體免疫細胞攻擊受體器官引發的致命并發癥,傳統激素治療有效率僅50%,耐藥患者生存率不足20%48。臨床試驗顯示,間充質干細胞通過免疫調節機制,對多重耐藥aGVHD總有效率提升至57%-73%,顯著優于二線單藥治療。
起效時間與療程設計:探索性II期臨床表明,藥物在輸注后平均2周逐漸顯現療效,完成8次輸注(標準療程)的腸道受累患者獲益更顯著。完整療程是療效保障的關鍵,單次使用可能無法達到預期效果。
02、安全性:附條件批準下的風險監控
短期風險可控:當前臨床試驗中“未觀察到重要安全性風險”,但作為中國首個附條件批準的干細胞藥物,需持續完成上市后研究,尤其關注長期潛在風險(如異常增殖、免疫失衡等)。
嚴格使用場景限制:該藥為處方藥,僅限正規醫院在醫生監督下使用。國家藥監局明確警示:非醫療機構使用所謂“干細胞產品”可能導致感染、炎癥甚至獲得性疾病風險。
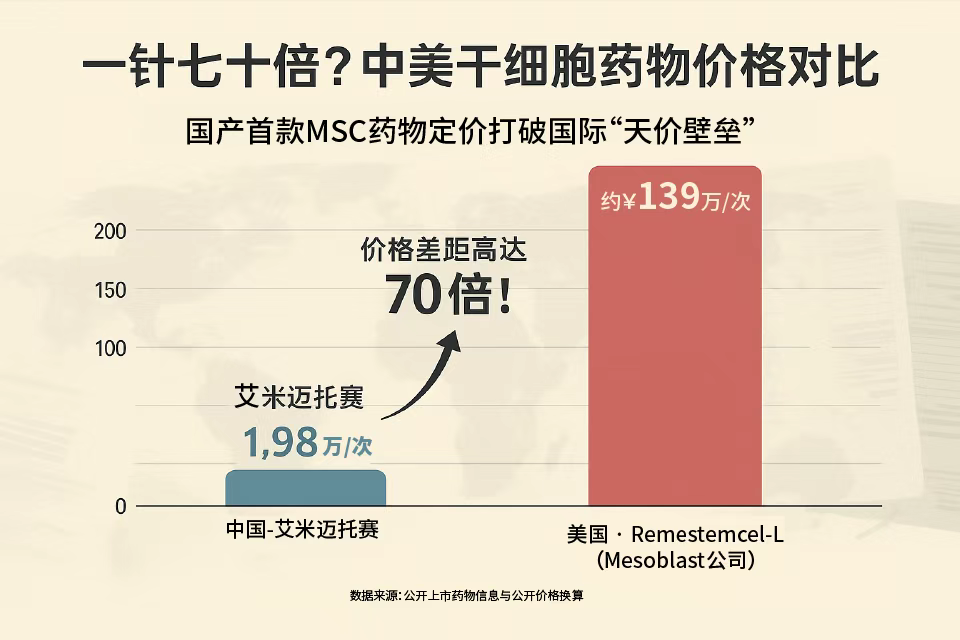
03、費用解析:普惠定價背后的技術革命
| 治療費用對比 | 睿鉑生(中國) | Ryoncil(美國) | 價格比例 |
|---|---|---|---|
| 單次治療費用 | 1.98萬元 | 19.4萬美元(約138萬元) | 1.4% |
| 完整療程費用 | 15.84萬元(8次) | 155.2萬美元(約1100萬元) | 1.4% |
| 適用人群 | 14歲以上aGVHD患者 | 2個月以上兒童患者 |
低價實現的三大支柱
- 技術突破:依托華龕生物3D微載體自動化生產技術,單批次產能達百億級細胞,人力與耗材成本降低60%;
- 支付創新:探索“療效分期付款”——無效可申請部分退款,降低患者經濟風險;
- 政策支持:國家研發補貼+海南樂城真實世界數據加速審批,縮短30%研發周期。
04、公眾關切:理性看待希望與局限
適應癥拓展需科學驗證:雖301醫院已啟動血管衰老、糖尿病腎病等新臨床試驗,但現階段僅aGVHD為獲批適應癥。其他用途仍處研究階段,公眾需警惕“萬能干細胞”誤導宣傳。
支付能力與醫保困境
- 現狀:15.8萬療程費對普通家庭仍屬高負擔,參考CAR-T療法(120萬元未進醫保),短期納入國家醫保可能性低;
- 解決方案:地方醫保試點(如北京已覆蓋造血移植)、商保合作、慈善援助等多層次支付體系正在構建。
行業監管與“黑市”風險:截至2023年12月,全國僅141家機構獲干細胞研究備案。市面上“干細胞美容”“口服干細胞”等均為非法產品,存在嚴重安全隱患。
05、總結:理性看待的四個關鍵點
療效明確但有限:當前僅推薦用于aGVHD,其他適應癥待驗證;
安全性需長期監測:附條件批準要求持續風險評估;
價格革命≠全民可及:技術突破實現全球最低價,但支付創新仍需推進;
行業里程碑意義:標志著中國干細胞治療從實驗室邁向規范化醫療,為糖尿病、心衰等大病種藥物研發鋪路。
總體來看,艾米邁托賽的上市,是干細胞藥物從“罕見病治療”向“多適應癥拓展”的關鍵一步。這背后不僅考驗產品生產和質量控制的一致性,更需要真實世界數據的支撐,以及支付體系的逐步完善,才能真正擴大臨床受益人群。
未來一年,隨著301醫院等權威機構的研究數據陸續發布,我們或許將見證它在血管衰老、糖尿病腎病、急性腎損傷等高發慢病領域的潛在突破。
寫在最后:隨著艾米邁托賽注射液首張處方落地,中國干細胞治療正式進入“雙軌時代”:一軌是當下——19800元/針的普惠定價讓1500名年新增耐藥aGVHD患者免于絕望;另一軌通向未來:301醫院血管衰老研究的140個招募名額,海南博鰲樂城正在加速審批的糖尿病足適應癥,以及細胞治療費用進入醫保的倒計時推演(2027年降至5-8萬元)。當救命藥從“天價孤品”蛻變為“民生選項”,這場始于aGVHD的生命救援,終將重塑14億人的健康未來。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信