創傷性脊髓損傷(SCI)會導致神經組織直接和間接損傷,導致運動和感覺功能障礙、肌張力障礙和病理反射,最終導致截癱或四肢癱瘓。細胞損失、軸突再生失敗和時間敏感的病理生理學使組織修復變得困難。盡管醫學取得了各種進展,但目前還沒有有效的再生治療方法。干細胞療法因其多靶點和反應性優勢而成為一種很有前途的SCI治療方法。
本綜述重點關注干細胞治療脊髓損傷,包括骨髓間充質干細胞、臍帶間充質干細胞、脂肪間充質干細胞、神經干細胞、神經祖細胞、胚胎干細胞、誘導多能干細胞和細胞外囊泡。每種細胞類型都針對SCI病理學的某些特征,并通過細胞替代、營養支持、支架和免疫調節機制顯示出治療效果。然而,許多臨床前研究和越來越多的臨床試驗發現,單細胞治療對SCI的益處有限。SCI損傷是多方面的,越來越多的人認為需要綜合治療。

介紹
脊髓損傷 (SCI) 是一種毀滅性損傷,給患者和醫療保健系統帶來廣泛的心理和經濟負擔。據估計,僅在美國就有超過100萬人受SCI影響,每年約有17,000例新病例。目前的治療方法包括脊柱減壓手術、痙攣治療和康復治療。盡管臨床管理方面取得了一些進展,改善了患者的生活質量,但SCI的恢復非常有限,尋找癱瘓的替代療法仍然是首要任務。
時間敏感且復雜的病理生理學使得研究SCI的治療靶點變得特別困難。在最初的機械損傷之后,會出現一系列繼發事件,使患者的病情惡化。炎癥反應、神經膠質增生、抑制環境的形成和疤痕形成阻礙軸突再生并限制許多治療干預的潛力(圖1)。
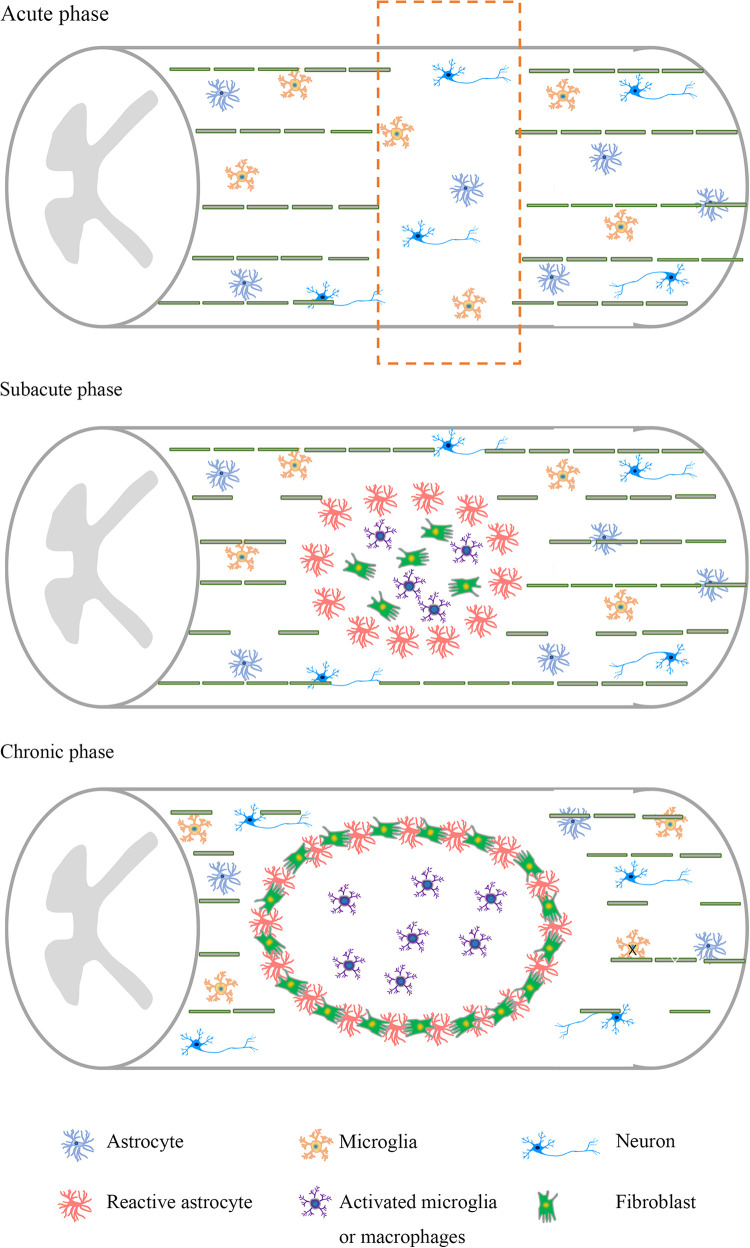
急性期神經元凋亡和軸突損傷大量發生。在亞急性階段,神經元、軸突和髓磷脂大量損失。活化的星形膠質細胞、活化的小膠質細胞和巨噬細胞在損傷部位積聚。慢性階段,膠質疤痕和損傷空腔進一步發展,形成抑制性微環境。
細胞療法在SCI中表現出神經保護和神經再生潛力,具有不同的靶點和對刺激的反應,例如調節炎癥反應、提供營養支持和提高可塑性。通過這些過度的潛在機制,來自不同組織來源的各種細胞,包括骨髓間充質干細胞(BM-MSCs)、臍帶間充質干細胞(U-MSCs)、脂肪源性間充質干細胞(AD-MSCs)、神經干細胞研究人員對神經祖細胞 (NSC)、神經祖細胞 (NPC)、胚胎干細胞 (ESC)、誘導多能干細胞 (iPSC) 和細胞外囊泡 (EV) 進行了研究。以往的綜述討論了SCI的細胞治療,但缺乏系統的闡明,例如這些細胞的原始功能、修飾細胞的功能以及聯合治療的效果。(表格1)。
表格1。
不同干細胞對脊髓損傷的影響。
| 細胞類型 | 效果 |
|---|---|
| 骨髓間充質干細胞 | 分泌神經營養因子 促進軸突再生 減少星形膠質疤痕密度 減少炎癥反應 減少BSCB滲漏 調節自噬 減輕神經性疼痛 提高膀胱順應性 |
| U-MSCs | 保護神經元 抑制神經膠質疤痕 減少反應性星形膠質細胞 減輕脊髓缺血性損害 減輕異常性疼痛和痛覺過敏 改善肌肉張力、膀胱功能和尿液控制 改善SSEP 減輕神經性疼痛 |
| AD-MSCs | 保護神經元 促進細胞存活和組織修復 抑制免疫活性 分泌抗炎因子 激活血管生成 減少蛀牙形成 改善感覺和運動功能 改善勃起功能障礙 |
| NSC 和 NPC | 增加神經保護細胞因子 改善細胞增殖 增加髓鞘形成 調節炎癥反應 促進呼吸恢復 |
| ESC | 促進星形膠質細胞增生 使軸突能夠通過CSPG 支持節點結構 減輕神經性疼痛 |
| 誘導多能干細胞 | 改善神經營養因子分泌 促進軸突出芽 抑制脫髓鞘 促進突觸形成 抑制神經膠質疤痕 縮小病變大小 改善呼吸功能 |
| 干細胞衍生的EV | 調節軸突再生 保護細胞免于凋亡 抑制星形膠質細胞的活化 抑制炎癥 減少損傷范圍 保護BSCB的完整性 |
干細胞移植治療脊髓損傷的策略
骨髓間充質干細胞
BM-MSC是存在于成人骨髓中的部分分化的祖細胞,支持持續的造血和骨再生。這些細胞最初被認為是多能的,具有分化成神經元和神經膠質細胞的能力。然而,其他研究表明,BM-MSC療法主要涉及細胞融合和轉分化,而不是細胞分化。早期體內研究表明,將BM-MSC引入脊髓挫傷大鼠的病變部位會導致星形膠質細胞和神經元前體組織束的形成。將BM-MSC引入損傷部位可減少炎癥反應、星形膠質細胞疤痕密度,以及血脊髓屏障 (BSCB) 滲漏;調節性星形膠質細胞增生;減輕神經性疼痛;并改善了后肢運動的功能恢復,這可能涉及基質金屬蛋白酶(MMP)2/STAT3通路。來自MSC的條件培養基對SCI具有治療作用,并可能調節自噬和生存相關蛋白Olig2和HSP70。
一項基于BM-MSC治療頸椎SCI患者的縱向研究擴增了自體BM-MSC,并通過硬膜內注射引入這些細胞。移植后6個月,10名候選人中有6名觀察到上肢運動功能和磁共振成像 (MRI) 圖像有所改善。6名完全性SCI患者接受自體MSC和SC治療,結果顯示美國脊髓損傷協會 (ASIA) 分級、膀胱順應性和軸突再生有所改善。
同樣,一名慢性SCI患者接受MSC治療,神經功能和行走能力均得到改善。然而,一項III期臨床試驗表明,單次MSC應用是安全的,但治療效果甚微。這一結果可能與 MSC 移植的時機有關,因為慢性SCI中干細胞的歸巢能力并不明顯。由于關于患者對 BM-MSC 療法的反應程度的報道存在爭議,因此必須進一步證實BM-MSC的療效。多項試驗正在進行中,這些研究的完成將為啟動對BM-MSC療法的功效進行更大規模的研究提供所需的信息。
總體而言,BM-MSC治療通過改善損傷部位的微環境、增強營養支持、調節炎癥反應和減輕BSCB滲漏而有利于SCI的恢復。患者通過接受自體細胞移植來避免免疫反應。因此,BM-MSCs 由于其免疫原性降低和可用性提高而在SCI治療中具有巨大潛力。
臍帶間充質干細胞
最近的研究調查了從臍帶和脂肪組織中分離的間充質干細胞。U-MSC 具有發育成表達神經標記物并形成神經表型特征的同質群體的能力。早期研究發現移植后U-MSCs遷移到損傷部位而不是非損傷區域,這為其治療效果奠定了基礎。
先前的研究表明,U-MSC可以保護神經元免于凋亡,通過調節MMP2抑制神經膠質疤痕的形成,減輕脊髓缺血性損害,減少反應性星形膠質細胞,改善運動功能,減輕動物實驗中SCI后的異常性疼痛和痛覺過敏。U-MSC對各種動態范圍的神經元表現出比BM-MSC更好的效果。Park及其同事發現,移植的U-MSC在SCI后1周表現出比12小時和2周更好的效果,這表明了治療SCI的潛在時間點。
U-MSCs注射到壓縮性骨折患者脊髓的蛛網膜下腔、硬膜內或硬膜外間隙后,可改善下肢的運動功能并擴張萎縮的脊髓。U-MSC移植后,10名胸腰段SCI患者中有7名的運動、肌張力、膀胱功能和尿液控制與單獨接受康復治療的患者相比有明顯改善。完全性頸椎SCI患者2年體感誘發電位(SSEP)和神經病理性疼痛臨床表現在U-MSC移植1年后明顯改善和減輕,SSEP反映了有髓大纖維的生理功能。由于臍帶通常被丟棄,因此U-MSC很容易獲得。U-MSCs從臍血、血管周圍區域和臍靜脈內皮下獲得,沒有倫理問題,這些細胞通過不同的機制有利于SCI的恢復。需要進一步努力來全面評估UC-MSC移植的有效性。
脂肪來源的間充質干細胞
AD-MSC和BM-MSCS有一些相似之處,例如形態和細胞表面抗原表達,但它們在增殖速率和多譜系能力方面有所不同。脂肪組織比骨髓含有更多的成體干細胞,這使得AD-MSC成為MSC的良好候選者,特別是考慮到脂肪組織的可用性。
AD-MSC移植在慢性和急性SCI中顯示出令人滿意的效果。靜脈注射AD-MSC可激活血管生成并上調ERK和 Akt,從而改善后肢運動功能。AD-MSC還通過增加β3-微管蛋白、BDNF和睫狀神經營養因子 (CNTF) 的表達來促進細胞存活和組織修復。AD-MSC可以保護SCI大鼠的神經元并改善勃起功能障礙。
一項研究調查了14名接受鞘內移植的SCI患者自體AD-MSC移植的效果。ASIA感覺和運動評分以及電生理學評估(包括 MRI 和肌電圖)用于確定效果。干預后,10名患者出現感覺改善,但MRI顯示的病變大小保持穩定。使用AD-MSC治療的患者均未出現嚴重不良事件。
神經干細胞(NSC)和神經祖細胞(NPC)
NSC和NPC是從腦室和海馬的室下區域以及脊髓中央管的室管膜區域中分離出來的多能細胞。這些細胞能夠分化為特定的神經元或神經膠質細胞,增強髓鞘再生并提供營養支持,這使得它們適合用于SCI的細胞移植治療。
NPC主要分化為少突膠質細胞,增加髓鞘形成,并改善后肢功能。一項研究還表明,移植從腦室下區獲得的NPC可促進SCI后的呼吸恢復,而分化則不起作用。鼻咽癌移植增加了NGF、CNTF、BDNF、IGF-1和GDNF的表達,有利于SCI恢復。NPC還通過抑制反應性巨噬細胞和T細胞以及神經保護性細胞因子的分泌來調節炎癥反應。先前的研究表明,急性期NPCs移植的療效優于亞急性期和慢性期,并且完整軟組織移植可能比亞急性期損傷部位移植產生更好的療效。
2018年的一項研究表明,病灶周圍髓內注射NSC是安全的,但劑量應進行驗證。12名肌萎縮側索硬化癥患者接受了人脊髓來源的 NPC 移植,結果表明NPC移植是安全的,從而啟動了進一步的臨床試驗。NPCs顯示出治療 SCI 的巨大潛力,但功能恢復有限。典型的組合方法為提高NPC的功效帶來了很大希望。然而,以往的研究普遍以嚙齒類動物為受試者,應將一些與人類較接近的特定大型動物作為實驗對象,以解決問題并走向臨床轉化。
胚胎干細胞
胚胎干細胞是多能干細胞,能夠在體內分化成新的細胞類型。ESC分化為神經元和神經膠質細胞,以取代SCI中的無功能細胞或組織。然而,由于致瘤性的風險,它們的未分化形式很少使用。先前的研究表明ESC移植對 SCI恢復有效。ESC轉染了細胞粘附分子L1,可促進神經元存活和神經突萌芽,在SCI治療方面具有廣闊的前景。
2014年的一項臨床研究表明,人ESC來源的少突膠質細胞祖細胞移植對于SCI患者是安全的。2016年的另外兩項研究表明,SCI患者在接受人類ESCs干預后,身體功能得到了恢復,并且沒有出現嚴重的并發癥。然而,由于ESCs具有相當大的增殖能力,其多能性可能導致腫瘤形成。在細胞培養過程期間可能存在遺傳變化。因此,優化分化方案以減少腫瘤發生并控制細胞群以滿足SCI患者不同的恢復要求至關重要。
誘導多能干細胞
由于ESC的起源,關于ESC存在很大爭議。iPSC與ESC具有相同的多能特性,可能會解決這個問題。iPSC 由重編程的體細胞產生,與可觸及的組織(例如自體皮膚)分離,這避免了倫理問題,允許自體細胞移植,并防止排斥。
源自人類iPSC克隆的NP可修復損傷部位。IPSC衍生的神經干/祖細胞 (iPSC-NS/PC) 抑制脫髓鞘并促進突觸形成和神經營養因子分泌,從而改善普通狨猴SCI后的功能恢復,且不形成腫瘤。
一份病例報告表明,來自健康86歲男性的iPSC衍生的NSC分化為神經元和神經膠質細胞,細胞移植后軸突延伸很長的距離并形成突觸。另一項研究表明 iCaspase9 基因減輕了 iPSC 衍生移植后的不良事件。另一項研究表明,用 RGD 肽和血小板衍生生長因子 (PDGF-A) 修飾的水凝膠可促進細胞存活和分化,并減少畸胎瘤形成。
其他組合方法
神經保護
神經保護藥物旨在最大限度地減少病理損傷并保護神經組織。只有甲基潑尼松龍已被臨床證明可以在SCI 后提供益處,但它也帶來一些風險,包括胃腸道出血、傷口感染和血栓栓塞。然而,越來越有前景的神經保護干預措施正在研究中(例如軟骨素酶、藻酸鹽支架、TNF-α拮抗劑、抗Nogo抗體、米諾環素和薰衣草提取物)。這些干預措施可在細胞移植之前或期間使用,以創造提高干細胞功效的微環境。低溫治療與細胞療法相結合已成功用于神經保護。低溫可降低基礎代謝率并減少炎癥,從而在 SCI 中發揮協同作用。米諾環素可協同提高MSC的抗炎作用。盡管初步結果令人鼓舞,但仍需要開展更多工作來優化聯合治療的療效。
生物材料
盡管干細胞療法在SCI治療領域取得了巨大的發展勢頭,但仍有改進的空間。生物材料的使用是一種令人鼓舞的細胞治療方法,它可以橋接病變腔、替換受損的細胞外基質以及整合宿主組織和移植細胞。基質膠主要由層粘連蛋白、IV型膠原蛋白、硫酸乙酰肝素蛋白聚糖和支持細胞存活和分化的生長因子組成;增加神經元標記物;減少纖維化、星形膠質細胞增生標記物和炎癥因子;?并增強SCI動物的行為恢復。
許多種類的生物材料支架已被用于將間充質干細胞遞送至受損的脊髓。與NPC不同,MSC可能提供營養支持,促進軸突再生和血管生成,并減少炎癥。改良的可生物降解的幾丁質導管與BM-MSC移植相結合,改善了MSC的微環境,防止疤痕形成,并促進右脊髓半切損傷后的恢復。
總的來說,使用生物材料是 SCI 細胞治療的一種有前途的組合方法,它可以改善細胞植入、傳遞某些因子、促進神經標志物表達和軸突再生、抑制炎癥反應以及接觸受損的中樞神經系統 (CNS) 組織。
挑戰與前景
干細胞在SCI細胞治療中具有神經再生和神經保護作用。SCI中的細胞療法在功能恢復方面具有不同的機制,例如免疫調節、細胞替代營養和支架支持。然而,干細胞療法存在特殊的安全問題。
首先,臨床前研究中經常討論細胞治療相關的免疫毒性、免疫原性和致瘤性。
其次,有限的細胞存活和有限的整合是先前研究中不同實驗設計的常見障礙,包括細胞數量、治療時機和移植策略。
第三,確保干細胞的遺傳穩定性、世代一致性和儲存安全性。干細胞移植的質量和可重復性對于臨床轉化至關重要。細胞起源和生長條件的微小差異可能會對結果產生重大影響。
第四,應進一步研究其作用機制和生物學特性,以指導臨床應用。最后,樣本量小、監管有限、質量差是大多數注冊臨床試驗的共同問題,阻礙了干細胞療法的發展。由于損傷類型和程度的異質性、治療的特定時間以及移植細胞數量的不同,標準方案很難確定。
令人鼓舞的臨床前研究,加上宣傳,導致了早期的臨床部署,但結果好壞參半。一種特定類型的干細胞只能實現有限的治療效果。因此,許多研究人員致力于增強干細胞的功效。基因工程技術、細胞偶聯、神經保護劑、營養因子、生物材料和康復的聯合治療可能有助于提高干細胞在異質患者群體中的治療效果。需要進行研究來優化它們的使用。
結論
盡管干細胞療法為脊髓損傷的治療提供了重要前景,但臨床轉化仍存在許多障礙。這些障礙包括合適的細胞類型和來源、細胞存活、干細胞的質量和可重復性以及最佳移植劑量和時機。實驗動物與人類存在內源性差異,臨床轉化前還需要完成大量工作。每種類型的干細胞都有獨特的好處。
以往的研究已經集中在如何增強干細胞治療脊髓損傷的功效上并取得了積極的成果。未來的治療可能會使用各種新策略來解決SCI問題。
參考資料:Huang L, Fu C, Xiong F, He C, Wei Q. Stem Cell Therapy for Spinal Cord Injury. Cell Transplant. 2021 Jan-Dec;30:963689721989266. doi: 10.1177/0963689721989266. PMID: 33559479; PMCID: PMC7876757.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信