神經干細胞-祖細胞 (NSPC) 是多能、自我更新的細胞,可產生放射狀膠質細胞 (RGC)。RGC 隨后在神經發育過程中產生神經元和膠質細胞。在這里,我們描述了 NSPC 分離和培養以形成稱為神經球的克隆聚集體的過程。本章概述了多種檢測方法,使我們能夠量化這些細胞的增殖、自我更新潛力和分化的差異[1]。
神經干細胞培養權威指南:NSPC高效提取與分化技術解析
1簡介
在干細胞和祖細胞研究領域,了解控制神經生物學的復雜過程對于理解大腦內的功能通路至關重要。干細胞和祖細胞具有分化成神經系統內各種細胞類型的非凡能力,這使得它們對于研究神經發育和神經退行性疾病或創傷相關損傷的潛在治療應用具有無價的價值。然而,理解控制其行為的潛在機制需要可靠且多功能的實驗技術。
近年來,神經球測定法就是一項獲得廣泛認可的技術。該測定法最初 1992年開發,現已成為神經干細胞研究的基石。該測定法能夠從中樞神經系統的不同區域(包括胚胎、胎兒和成人階段)分離、擴增和表征神經干細胞。此外,該測定法還能檢查干細胞和祖細胞對各種基因和藥理操作的反應,為神經發育過程、神經再生和疾病建模提供有價值的見解。這些神經球由一群異質性細胞組成,其中包括神經干細胞和祖細胞,它們能夠分化成中樞神經系統的主要細胞類型,包括神經元、星形膠質細胞和少突膠質細胞。通過利用特定的生長因子和培養條件,研究人員可以有效地維持干細胞和祖細胞的自我更新能力,促進其增殖并防止自發分化。
這項檢測為研究干細胞和祖細胞神經生物學提供了許多優勢。
首先,神經球檢測可以大量擴增神經干細胞和祖細胞,同時保留其多能性。
其次,神經球檢測提供了一種三維 (3D) 培養系統,更接近于體內微環境。神經球的3D特性為干細胞和祖細胞提供了支持性的“體外環境”,模擬了神經系統中的細胞相互作用和空間組織。
第三,神經球檢測可以檢查干細胞和祖細胞對各種因素和刺激的反應。通過調節培養基的成分,研究人員可以研究生長因子、小分子和其他生物線索對干細胞行為的影響。此外,該檢測法還允許引入基因操作,例如基因過表達、缺失或敲低,以剖析干細胞和祖細胞神經生物學中涉及的分子通路。神經球檢測法還提供了藥物篩選和毒性測試的機會,有助于開發新的治療策略。
最后,這些 NSPC 的分化能力也可以在體外建模,從而確定提取的細胞中特定的祖細胞群是否可能受到損害。
總之,神經球試驗已成為了解干細胞和祖細胞神經生物學的寶貴工具。它能夠擴增和維持多能細胞,具有3D培養環境,并且能夠靈活地研究各種因素和疾病,使其成為揭示控制神經發育、再生和疾病進展的復雜機制的理想系統。
2材料
2.1 NSPC 分離和培養
- 1.磷酸鹽緩沖液 (PBS):配置10×溶液,將80gNaCl、2 g KCl、14.4 g Na?2?HPO?4加至 800 mL 蒸餾水。調節 pH 至 7.4 并加至 1 L。對于 1× PBS,將 100 mL 10× PBS 加至 900 mL 蒸餾水。
- 2.漢克斯平衡鹽溶液(HBSS)。
- 3.神經球基礎培養基(NSBM;1:1 杜氏改良伊格爾培養基 [DMEM] 和 F12、4 μg/mL 肝素、100 μg/mL 青霉素/鏈霉素)。
- 4.堿性成纖維細胞生長因子 (bFGF)。
- 5.表皮生長因子(EGF)。
- 6.B27(不含維生素A)。
- 7.低粘附性 6 孔組織培養板。
- 8.神經球解離溶液(50 mL HBSS、0.01 g EDTA、0.0125 g 胰蛋白酶 [0.25 mg/mL]、0.119 g N-2-羥乙基哌嗪-N’-2-乙磺酸 [HEPES],pH 值 8;以 1 mL 分裝在 ?20 °C 下冷凍,使用前立即解凍)。
- 9.中和溶液(50 mL HEPES 緩沖 DMEM、0.007 g 大豆胰蛋白酶抑制劑 [0.14 mg/mL],以 1 mL 分裝在 ?20 °C 下冷凍,使用前立即解凍)。
- 10.60 孔 Terasaki 細胞培養板。
- 11.二甲基亞砜(DMSO)。
2.2神經球分化
- 1.8孔腔室載玻片。
- 2.聚-D-賴氨酸和層粘蛋白。
- 3.胎牛血清(FCS)。
- 4.4% 多聚甲醛 (PFA):將 4 克 PFA 與約 70 毫升去離子無菌水混合。在 60 °C 下搖動溶解。溶解后,過濾 PFA,并用無菌去離子水加滿至最終體積 100 毫升。
- 5.用于識別神經元 (小鼠抗 Tuj1) 和星形膠質細胞 (兔抗 GFAP) 的一抗。
- 6.二抗山羊抗鼠 555 和山羊抗兔 488。
- 7.4′,6-二脒基-2-苯基吲哚 (DAPI)。
- 8.水性封固劑。
2.3逆轉錄病毒轉導
- 1.0.5 M氯化鈣。
- 2.穩定轉導逆轉錄病毒gag和pol基因的人類胚胎腎 (HEK) 細胞 (HEK-293gp;病毒包裝細胞系)。
- 3.含有 5% FCS 和100μg/mL青霉素/鏈霉素的 DMEM(DMEM/FCS/PS)。
- 4.60cm2個組織培養板。
- 5.DMEM補充有5-10%FCS和100μg/mL 青霉素/鏈霉素。
- 6.2× HEPES 緩沖鹽水,pH 值 7.0 (HeBS)。
- 7.包含目的蛋白質的逆轉錄病毒載體(例如MSCV)。
- 8.水泡性口炎病毒糖蛋白(VSVG)包膜質粒。
- 9.5 mL 注射器和0.45μm注射器過濾器。
- 10.超速離心機和10mL超速離心管。
- 11.水中重組纖連蛋白 (rFN)濃度為1mg/mL。
- 12.補充有2%牛血清白蛋白 (BSA) 的PBS。
- 13.24孔組織培養板。
3方法
3.1胚胎NSPC分離
- 1.在E14.5時對懷孕的母鼠實施安樂死,從子宮中收集胚胎,并立即放入含有冷 PBS 的培養皿中。
- 2.一次一個地去除胚胎的絨毛膜并除去胎盤(見注釋1)。
- 3.解剖胚胎的頭部,并在解剖顯微鏡下輕輕地將頭骨從大腦中切掉。
- 4.接下來,沿矢狀切開大腦,將其分成左、右半球。
- 5.去除每個半球的外部皮質,留下內側、尾部和外側神經節隆起(見注釋2)。
- 6.一旦解剖,將神經節隆起放入含有5mL新鮮HBSS的15mLFalcon管中,放在冰上,直到所有大腦都被解剖(圖1)。
- 7.在層流罩中,用移液器輕輕研磨以分解組織。
- 8.將分解的組織以1200×g的速度離心5分鐘。
- 9.去除上清液并將細胞重新懸浮在5mL NSBM中,補充10ng/mL堿性成纖維細胞生長因子、20ng/mL 表皮生長因子和 1:50 B27(不含維生素 A)。
- 10.將細胞轉移到低粘附性6孔板中,使細胞形成克隆聚集體(神經球)。
- 11.在37 °C和5%CO2條件下孵育細胞。
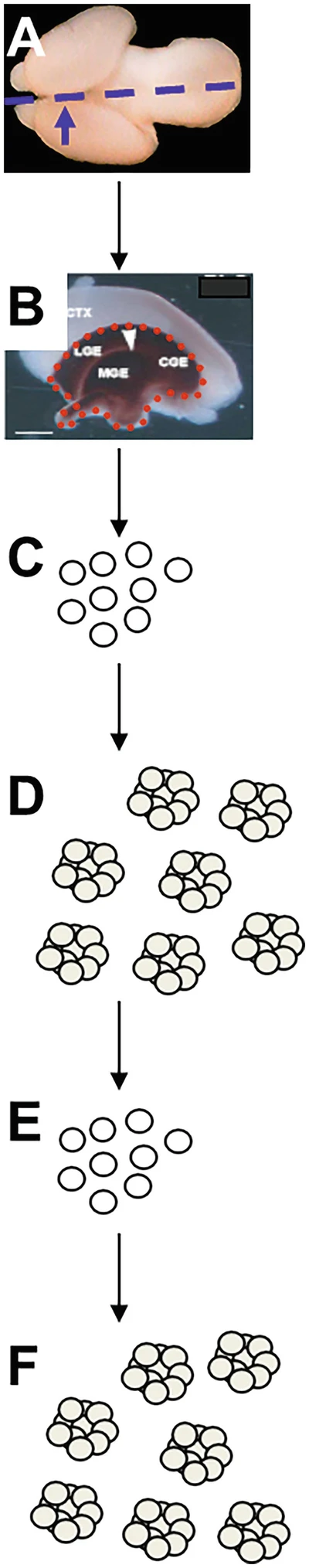
胚胎采集后,將腦從顱骨中取出 (?a?)。接下來,去除皮質層,只留下外側、內側和尾部神經節隆起(分別為 LGE、MGE 和 CGE;b)。然后用移液器輕輕打碎,留下單細胞懸浮液 (?c?)。培養后,GE 中的神經干細胞/祖細胞 (NSPC) 形成克隆聚集體,稱為神經球 (?d?)。這些可以分離(“傳代”)成進一步的單細胞懸浮液 (?e?) 并重新接種,在那里它們將再次重新形成神經球 (?f?)
3.2 NSPC文化
- 1.每2天取出2.5mL(一半體積)培養基(注意避免丟棄神經球;參見?注釋 3)。
- 2.加入2.5mL新鮮NSBM,其中含有1:50不含維生素A的B27以及兩倍濃度的 EGF 和 bFGF(20 ng/mL βFGF、40 ng mL EGF;稱為 NSBM+2×GFs)。這將確保 GFs 的最終濃度保持在 1×。
3.3神經球解離和傳代
- 1.維持培養直至大多數神經球變大,中心呈深色(約5-7天生長;圖2)。培養基將開始變成橙色/黃色。
- 2.為了傳代,將細胞轉移到15mL Falcon 管中,并以700×g離心7分鐘。
- 3.除去上清液并在室溫下將神經球輕輕懸浮在 500 μL 解離溶液中3分鐘,并輕輕研磨。
- 4.在室溫下用500 μL中和溶液中和解離溶液3分鐘,并輕輕研磨。
- 5.接下來,通過添加 8 mL NSBM 來清洗分離的細胞,然后在1300×g下離心5分鐘?。
- 6.去除上清液并將細胞重新懸浮在 1 mL NSBM 中,進行細胞計數。
- 7.取所需數量的細胞(取決于所進行的分析;見下文)并加入5mLNSBM+1×GF。對于常規傳代,細胞應以1–5 ×105個細胞/毫升的密度接種。
- 8.將新傳代的細胞放入6孔低粘附組織培養板的新鮮孔中,并在 37°C和5%CO2下孵育。
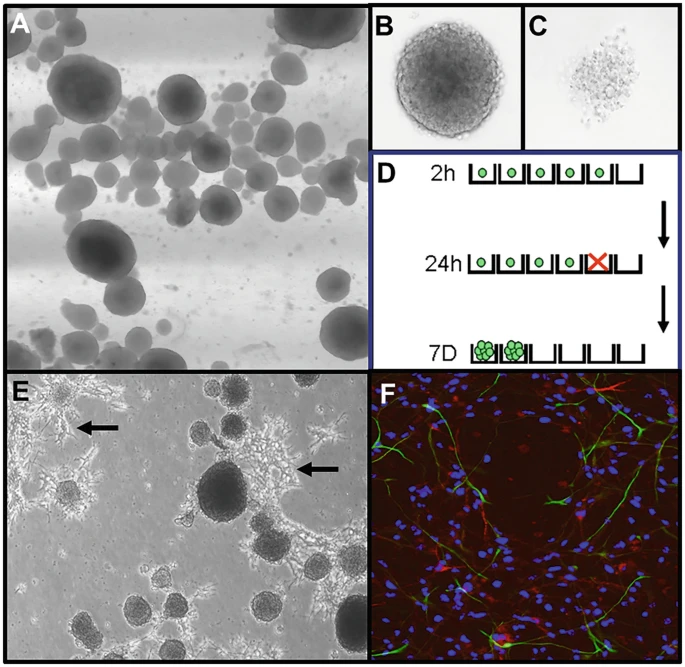
正常神經球生長為自由漂浮的球體 (?a?);健康、活的神經球將呈現為中心呈深色的實心球 (?b?),而大多數細胞已發生凋亡或壞死的神經球將呈現松散和蒼白 (?c?)。可將健康神經球分離并以 5 個細胞/10 μL 的密度接種于 Terasaki 板中(每板 60 個孔)。接種后(2 小時)立即存在的活細胞數量可進行定量分析 — 大多數孔中將有 0 個或 1 個細胞(綠點;d)。培養 24 小時后,很少細胞會開始分裂,但有些細胞將發生凋亡(紅色 x)。到 7 天時,任何具有自我更新潛力的細胞都將產生包含 >4 個細胞的神經球,而無潛力的細胞將發生凋亡。當在正常粘附板上生長時,神經球會粘附、長出突起(箭頭),并開始分化(e)。然后可以使用免疫組織化學(f)檢測,以可視化 Tuj1+神經元(紅色)和 GFAP?+星形膠質細胞(綠色)占所有細胞的比例(藍色細胞核;DAPI)
3.4累積細胞數測定
- 1.按照3.2節步驟2的步驟分離神經球后,計數細胞并以1-5×105細胞/mL的濃度接種于 NSBM + 1 × GF 的低粘附性6孔板上。
- 2.每 2-3 天,移除培養基并更換為新鮮的 NSBM + 2 × GF。這將確保細胞繼續在 NSBM + 1 × GF 中生長。
- 3.每7天,按照第3.2節步驟2進行細胞傳代,并記錄每周計數。根據神經球的健康狀況,應重復此操作 5-6 周。
3.5神經球存活率測定
- 1.在 NSBM +1 × GF 的低粘附性 6 孔板上,每孔接種約 20-50 個第 7 天神經球。
- 2.計算存在的神經球的確切數量。
- 3.將神經球放置 14 天,不要更換培養基或重新添加生長因子。
- 4.計算由仍然存活的細胞組成的神經球的確切數量(圖2)。
3.6克隆密度測定法測量不依賴于“體外微環境”的神經球形成
- 1.按照3.2節步驟2分離神經球,并對分離的細胞進行細胞計數。
- 2.將 1-2 × 10?4 個細胞放入 NSBM + 1 × GF 的低粘附性6孔板中,每孔培養。
- 3.每 2 天,取出培養基并用新鮮的 NSBM + 2 × GF 替換。這將確保細胞繼續在 NSBM + 1 × GF 中生長。
- 4.第 7 天,計算已形成的神經球的數量。
3.7單細胞分析確定神經球形成潛力
- 1.按照3.2節步驟2分離神經球,并對分離的細胞進行細胞計數。
- 2.將細胞以 500 個細胞/mL 的濃度重懸于 NSMB + 1 × GF 中。
- 3.將 10 μL 細胞懸浮液分裝到 60 孔 Terasaki 板的每個孔中。
- 4.統計 2 小時后每個孔中的細胞數。每個孔中應該有 0 或 1 個細胞;在極少數情況下,可能會看到 2 個細胞。
- 5.統計 24 小時和 48 小時時存在的細胞數量;一些 NSPC 可能已開始分裂。
- 6.在 48 小時時,向仍含有至少 1 個活細胞的孔中添加 10 μL NSBM + 2 × GF。
- 7.對已形成由≥4個細胞組成的神經球的孔數進行評分。
3.8分化試驗定量神經源性潛能
- 1.準備8孔腔室載玻片,每個孔涂上150μL聚-D-賴氨酸 + 20 μg/mL 層粘連蛋白。這將確保 NSPC 能夠粘附。
- 2.在室溫下孵育 1 小時。
- 3.去除聚-D-賴氨酸+層粘連蛋白并用 PBS 清洗 2 × 5 分鐘。
- 4.按照3.2小節步驟2解離 7 天培養的神經球,并對解離的細胞進行細胞計數。
- 5.以700×g的速度離心細胞7 分鐘。
- 6.將細胞懸浮在補充有 1% 胎牛血清的500μL NSBM + 1 × GF 中。
- 7.將1×105個細胞/孔放入 8 孔板中。
- 8.每 2 天取出培養基并替換為新鮮的 NSBM + 1 × GF + 1% FCS。
- 9.7 天后,在室溫下用 PBS 中的 4% 多聚甲醛固定細胞 30 分鐘。
- 10.接下來,用 PBS 中的 0.1% Triton X-100 對細胞進行通透 10 分鐘。
- 11.通過在 PBS 中的 3% 牛血清白蛋白 (BSA) 中孵育細胞 30 分鐘來進行阻斷。
- 12.與鼠抗 Tuj1(在封閉溶液中稀釋至 1:1000)(每孔 100 μL)一起在 4 °C 下孵育過夜。
- 13.用 PBS 清洗載玻片 2 次,每次 2 分鐘,然后在室溫下與山羊抗鼠 555 二抗孵育 30 分鐘,在封閉溶液中稀釋至 1:1000(每孔 100 μL)。
- 14.用 PBS 清洗載玻片 2 × 3 分鐘,然后用 PBS 中的 4% 多聚甲醛在室溫下固定 10 分鐘。
- 15.用 PBS 清洗載玻片 2 × 3 分鐘,并與兔抗 GFAP(在封閉溶液中稀釋至 1:500;每孔 100 μL)在 4 °C 下孵育過夜。
- 16.用 PBS 清洗載玻片 2 次,每次 2 分鐘,然后與山羊抗兔 488 二抗(每孔 100 μL)一起在室溫下孵育 30 分鐘,在封閉溶液中稀釋至 1:1000。
- 17.先用 PBS 清洗載玻片 3 次,每次 2 分鐘,然后在室溫下用 PBS 稀釋的 DAPI 孵育 5 分鐘。
- 18.使用提供的腔室拆卸工具小心地取出介質腔室,然后使用剃須刀片或美工刀刮掉膠水。
- 19.然后將載玻片安裝在水性封固劑中,并放置干燥過夜,然后進行成像(圖2)。
3.9冷凍神經球
- 1.培養神經球直至其達到一定的尺寸和密度,表明它們已準備好通過。
- 2.從培養容器(例如燒瓶、培養板)中取出神經球,以 700 ×??g的速度離心7 分鐘。
- 3.除去上清液并將細胞輕輕地重新懸浮在 500 μL NSBM + 2 × GF 中,其中含有 B27 的濃度為 1:25 而不是 1:50。
- 4.將神經球轉移到冷凍管中并置于冰上。將 500 μL 20% DMSO(溶于 DMEM)加入冷凍管中并輕輕混勻。
- 5.冷凍管應立即放入冷凍保存容器中,以確保緩慢冷凍。冷凍后,應將樣本放入液氮中保存。
3.10解凍神經球
- 1.將 NSBM + 1 × GF(每個樣品 5 毫升)預熱至 37 °C。
- 2.從液氮儲存中取出冷凍管并置于 37°C 下快速解凍。
- 3.立即將解凍的神經球轉移到預熱的培養基中,并以 700 ×g的速度離心7 分鐘。
- 4.除去上清液并將神經球輕輕懸浮在 5 mL 新鮮 NSBM + 1 × GF 中。
3.11逆轉錄病毒轉導
- 1.將HEK-293gp細胞放入60cm?2培養板中的DMEM/FCS/PS中,培養直至匯合率達到約90%。
- 2.將 500 μL 2 × HEPES 緩沖鹽水(pH 7.0)(HeBS)加入到 10 mL 聚丙烯管中。
- 3.將 10 μg 質粒/板與 10 μg/板水泡性口炎病毒糖蛋白 (VSVG) 包膜質粒和 0.5 M CaCl?2相結合,最終體積為 250 μL,用無菌 H?2?O溶解。
- 4.將質粒/VSVG 混合物逐滴添加到 HeBS 中,同時使空氣通過 HeBS 起泡(例如,使用移液器或類似設備)。
- 5.將反應混合物在室溫下孵育 20 分鐘。
- 6.逐滴加入HEK-293gp細胞中并在37°C、5%CO 2下孵育24小時。
- 7.取出培養基并替換為 10 mL NSBM。
- 8.將細胞在 37 °C、5% CO 2條件下孵育 72 小時。
- 9.從孔中取出細胞并以 1400 ×g的速度離心5 分鐘。
- 10.通過 0.45 μm 注射器過濾器過濾上清液以去除細胞碎片。
- 11.將上清液放入超速離心機,以 25,000×g的速度離心 90 分鐘,以濃縮逆轉錄病毒。
- 12.取出 9.5 mL 上清液,輕輕將逆轉錄病毒顆粒懸浮于 1 mL 新鮮 NSBM 中。病毒可以 500 μL 等分試樣形式儲存于 ?70 °C。
- 13.將 19 μg rFN 涂在 200 μL PBS 中的 24 孔組織培養板中的單個孔中,在 4 °C 下至少放置 16 小時。
- 14.在室溫下用 400 μL PBS + 2% BSA 清洗每個孔 30 分鐘。
- 15.在室溫下用 2 mL PBS 清洗 2 次。
- 16.向每個孔中添加 500 μL 逆轉錄病毒上清液,并在 32°C 下以 1500× g的速度離心?60 分鐘,以促進逆轉錄病毒顆粒與 rFN 結合。
- 17.按照3.2小節步驟2解離神經球,去除病毒上清液,并將 5×105個NSPC(含 NSBM + 1 × GF)接種到每個孔中(見?注釋 4)。
- 18.培養24h,除去NSBM,加入500μL神經球中和液。
- 19.孵育 3 分鐘,用移液器輕輕研磨細胞,并轉移到 15 mL 管中。
- 20.以1300 ×g的速度離心5 分鐘。
- 21.除去上清液,將細胞懸浮在 2 mL NSBM + 1 × GF 中,并轉移至超低附著6孔板(見注釋5)。
- 22.按照小標題3.2所述培養神經球。
- 23.如果逆轉錄病毒含有熒光標記,則使用熒光顯微鏡觀察成功感染的神經球(圖3)。
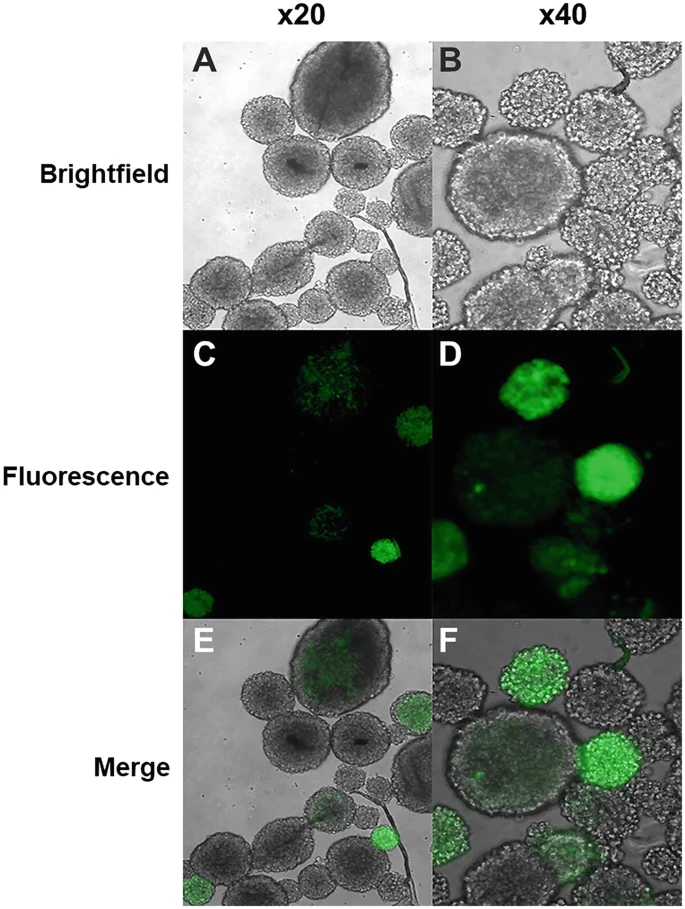
神經球(此處顯示為 20 倍和 40 倍)生長 7 天,分解,生長為單層,感染逆轉錄病毒,并重新形成神經球。在明場光學系統(a、b)和藍光(c、d)下檢查這些神經球,以識別 GFP+ 神經球。還顯示了合并的照片(e、f)
4注
1.將每個胚胎放在單獨的培養皿中解剖。如果需要對胚胎進行基因分型,則取出一小塊肢體組織、剩余的大腦或卵黃囊,以便隨后提取 DNA 并進行基因分型。
2.神經節隆起 (GE) 很容易被識別,因為它們在明視野顯微鏡下看起來比上面的皮質層更暗。
3.為了避免在更換一半培養基時丟失神經球,請輕輕旋轉培養板以收集每個孔中心的神經球(特別是對于>7 天的神經球)。然后可以從邊緣去除培養基,以確保神經球損失最小。
4.將神經球接種到這些培養皿中,可使神經干細胞以單層培養物(而不是漂浮的神經球)的形式生長,而不會誘導分化。單層培養將大大提高該技術中逆轉錄病毒的感染效率。
5.使用含有熒光報告基因的質粒非常有益,因為可以使用熒光激活細胞分選 (FACS) 分析確定陽性細胞和感染效率。
參考資料:Gasperoni, J., Dworkin, S. (2024). Neural Stem/Progenitor Cell (NSPC) Extraction and Culture. In: Dworkin, S. (eds) Neurobiology. Methods in Molecular Biology, vol 2746. Humana, New York, NY. https://doi.org/10.1007/978-1-0716-3585-8_9
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信