慢性腎臟病(CKD)是全球公共衛生領域的重大挑戰,其終末階段——晚期腎病(慢性腎臟病4-5期,CKD 4-5期)更是威脅患者生命健康的“隱形殺手”。據世界衛生組織(WHO)統計,全球約有8.5億人患有慢性腎臟病,其中約15%將進展至終末期腎病(ESRD),需依賴透析或腎移植維持生命。在中國,這一數字尤為嚴峻:2022年ESRD患者已超過385萬,預計2026年將突破500萬,且增速遠超全球平均水平。
目前傳統治療手段(如免疫抑制劑、降壓藥)僅能延緩病情進展,無法逆轉已造成的損傷。近年來,干細胞治療因其再生修復潛力,成為晚期腎病研究的熱點。
本文結合多項臨床研究與機制探索,分析干細胞治療晚期腎病患者的療效、局限性及未來方向。

晚期腎病的定義與分期
晚期腎病(Late-stage Chronic Kidney Disease)指慢性腎臟病(CKD)的4期和5期,此時腎功能嚴重受損,需依賴替代治療維持生命。其中,終末期腎病(ESRD,即CKD5期) 是最嚴重階段,腎小球濾過率(GFR)持續低于15 mL/min/1.73㎡,患者需通過透析或腎移植生存。
分期與臨床特征
- CKD4期:GFR為15–29 mL/min/1.73㎡,屬于重度腎功能損害。患者可能出現貧血、電解質紊亂(如高鉀血癥)及心血管風險升高,需積極干預以延緩進展。
- CKD5期(ESRD):GFR<15 mL/min/1.73㎡,腎功能幾乎完全喪失,無法排泄代謝廢物,需長期透析或腎移植。典型癥狀包括惡心、水腫、嚴重貧血及神經病變。
關鍵指標與并發癥:核心指標為 GFR和血肌酐水平,晚期腎病患者常伴隨代謝紊亂(如高鉀血癥、酸中毒)、心血管疾病風險增加及尿毒癥癥狀(如皮膚瘙癢、消化道不適)。及時管理并發癥對改善預后至關重要。
干細胞治療晚期腎病:修復無望還是緩解轉機?
一、干細胞治療晚期腎病的核心機制
1.抗纖維化與微環境調控:晚期腎病常伴隨腎間質纖維化與缺氧性損傷。間充質干細胞(MSC)通過分泌外泌體抑制TGF-β/Smad通路,減少膠原沉積,延緩纖維化進程。同時,干細胞分泌的VEGF、HGF等因子可促進局部血管新生,改善缺血區域的代謝微環境。
2.免疫調節與炎癥抑制:MSC通過抑制巨噬細胞活化和促炎因子(如TNF-α、IL-6)釋放,減輕全身性炎癥反應,緩解尿毒癥相關的免疫紊亂。這一機制對糖尿病腎病、狼瘡性腎炎等繼發性腎病尤為重要。
3.旁分泌修復與功能代償:干細胞無法直接替代已硬化的腎單位,但可通過旁分泌作用促進殘余腎細胞的增殖與功能恢復。例如,分泌的IGF-1、EGF等生長因子可增強腎小管上皮細胞的修復能力。
二、干細胞治療晚期腎病的療效與證據
案例1:干細胞治療晚期腎病患者的長期療效安全性評估
2020年,高雄長庚紀念醫院牽頭在行業期刊《干細胞轉化醫學》上發表了一篇關于《慢性腎臟病患者腎動脈自體CD34+細胞輸注的安全性和有效性:一項隨機、開放標簽、對照的II期臨床試驗》的臨床研究案例。
自體CD34+細胞是干細胞的一種,具體來說,它們屬于造血干細胞(HSCs)。

本次研究,納入2016年10月至2018年7月期間,52名連續患有III期或IV期的晚期慢性腎病患者被隨機分配到治療組和對照組。
在CD34?細胞治療研究中,所有患者均安全出院,未出現嚴重不良事件。基線檢測顯示,試驗組(TG)與對照組(CG)的內皮祖細胞水平無顯著差異。治療后,TG患者的循環EPC及造血干細胞(CD34?)數量顯著增加,且Matrigel血管生成能力顯著增強。
通過腎靜脈血樣動態監測(輸注后0、5、10、30分鐘)發現,TG患者的EPC水平呈時間依賴性逐步上升,表明CD34?細胞可能通過促進EPC增殖或歸巢發揮作用。(見圖1)
臨床結果顯示,TG患者1年內的綜合不良事件發生率顯著低于CG。然而,12個月隨訪時,兩組的循環肌酐水平、尿蛋白/肌酐比值及肌酐清除率均無顯著差異,提示CD34?治療對長期腎功能指標的改善只有輕微作用。
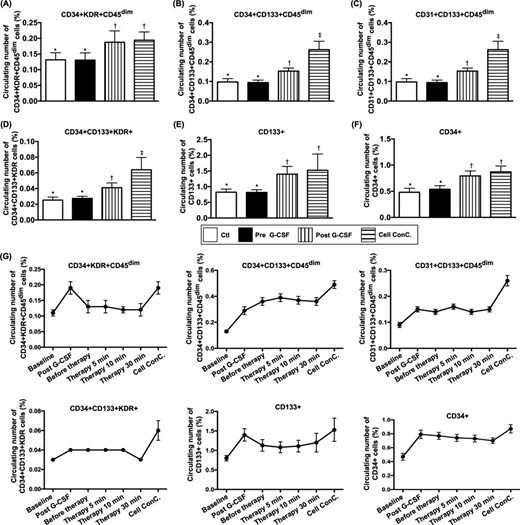
綜上所述,這項II期臨床試驗驗證了自體CD34?細胞治療晚期慢性腎病(III-IV期)的安全性和潛在療效,為干細胞療法在腎病領域的應用提供了關鍵證據。研究證實,CD34?細胞輸注可顯著提升患者循環內皮祖細胞(EPC)和血管生成能力,且未引發嚴重不良事件,同時將1年內不良臨床事件發生率降低,表明其通過促進血管修復和EPC歸巢機制延緩腎功能惡化。
案例2:細胞療法逆轉晚期腎病患者腎臟萎縮
2023年,尼加拉瓜國立自治大學外科牽頭在行業期刊《干細胞移植醫學》上發表了一篇關于《基質血管成分細胞療法治療原因不明的慢性腎病(中美洲腎病)的安全性》的臨床研究案例。

在這項首次人體開放標簽安全性研究中,納入了18名原因不明的晚期慢性腎病 (CKDu)(3-5 期)患者進行了36個月的隨訪。臨床研究結果表明:
1.腎臟體積改善:
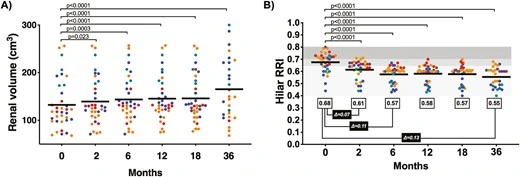
- 細胞治療后腎臟體積呈顯著恢復趨勢(非盲評估):12個月時36個腎臟中26個增大,36個月時(排除死亡患者)30個腎臟中24個仍大于基線(圖2A)。
- 該現象在慢性腎臟病進展中極為罕見,提示SVF可能通過修復機制逆轉腎臟萎縮。
2.血流動力學改善:
- 阻力指數(RRI)降低:基線平均肝門動脈RRI為0.68(晚期患者>0.70),治療后2個月降至0.61,6個月進一步降至0.57,36個月時維持穩定改善(圖2B)。
- 表明SVF通過改善腎血管收縮和血流灌注,緩解了CKD患者的腎內缺血狀態。
3.腎功能分層分析:
- 早期患者(3a/3b期,eGFR≥30 mL/min/1.73m2):
- 治療后2個月eGFR迅速回升,12個月時維持改善,36個月時功能恢復率分別達25.1%(3a期)和12.4%(3b期);
- 無患者進展至透析,而歷史對照組3b期患者在33個月時eGFR降至≤15并需透析。
- 晚期患者(4/5期,eGFR<30 mL/min/1.73m2):
- 治療初期eGFR短暫回升,但長期仍持續惡化:4期患者36個月時功能喪失29.2%,5期患者喪失45.3%;
- 與歷史對照組相比,細胞治療使4期患者透析時間延遲(圖3C),但未能逆轉終末期腎病進程。
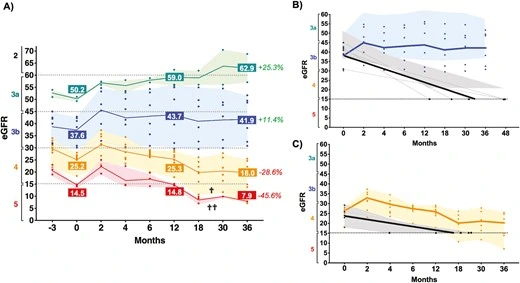
綜上所述,本研究首次系統驗證了細胞療法在慢性腎臟病(CKDu)中的安全性及潛在修復作用。盡管晚期患者仍無法避免腎功能惡化,但可以通過促進血管新生和腎臟修復延緩疾病進展。
案例3:干細胞移植使晚期腎病患者實現透析脫離
2024年,期刊《Oncology eJournal》上發表了一篇關于《自體干細胞移植治療多發性骨髓瘤:改善慢性腎病》的臨床研究成果。該研究納入了2019年1月至2022年12月期間接受首次自體干細胞移植(ASCT)的所有有癥狀的245名骨髓瘤 (MM)患者,旨在評估自體干細胞移植對慢性腎病的影響。

移植時所有245例患者均獲得估算腎小球濾過率(eGFR)數據,具體分布如下:
- 早期腎病(eGFR≥90):56.3%(n=138),腎功能正常或接近正常。
- 中期腎病(eGFR 60-89):23.7%(n=58),輕度至中度損傷。
- 中晚期腎病(eGFR 30-59):17.5%(n=43),腎功能顯著下降但未達終末期。
- 晚期腎病(eGFR <30):2.5%(n=6),4例患者需透析。
研究發現,在移植時患有慢性腎病的患者組中,當比較D0與D+100和D+365之間的eGFR變化時,發現移植后1年腎功能有顯著改善。(見圖4)
移植時4例晚期需透析的腎病患者中,1年后75.0%(n=3)擺脫透析,且所有4例均達到完全緩解。
重要的是,即使在中度或重度慢性腎病患者中也沒有觀察到腎功能的顯著惡化,并且沒有患者在移植后依賴透析。

綜上所述,在晚期腎病的多發性骨髓瘤(MM)患者中,自體干細胞移植(ASCT)展現出顯著療效:4例移植時需透析的終末期腎病患者中,75%(3/4)在移植后1年脫離透析,且全部患者達到完全緩解(CR)。此外,移植后無患者因腎功能惡化需重新依賴透析,表明ASCT不僅能有效控制腫瘤進展,還可通過改善腎功能逆轉終末期腎病的嚴重損傷,為傳統治療中預后極差的晚期腎病合并MM患者提供了新的治療選擇。
干細胞治療晚期腎病療效總結
綜合而言,對晚期腎病患者而言,干細胞療法雖無法完全逆轉終末期腎臟損傷,但其臨床價值顯著:
- 部分病例實現功能改善:例如,多發性骨髓瘤(MM)合并腎病患者接受自體干細胞移植(ASCT)后,4例透析患者中75%(3/4)在1年內脫離透析,且腎功能穩定;
- 延緩疾病進展:干細胞治療通過修復血管、抑制纖維化,降低不良事件風險,延緩腎功能惡化(如SVF細胞治療使晚期患者透析時間延遲);
- 結構修復潛力:部分研究顯示,干細胞可逆轉腎臟萎縮(如晚期CKDu患者治療后腎臟體積恢復),改善血流灌注。
盡管對嚴重纖維化或終末期損傷的修復有限,但干細胞為晚期患者爭取了“窗口期”,減少透析依賴并改善生存質量,為難治性腎病提供了再生醫學的新選擇。
三、干細胞治療晚期腎病的局限性
1.不可逆損傷的限制
晚期腎病患者通常已進入終末期(eGFR<30 mL/min/1.73m2),此時腎臟結構損傷已高度纖維化,腎小球硬化、腎間質瘢痕形成及腎小管萎縮等不可逆病理改變占主導。盡管干細胞可通過分泌抗纖維化因子(如TGF-β抑制劑)或促進血管新生延緩進展,但對已形成的膠原沉積和腎單位喪失難以逆轉。
2.個體差異顯著
干細胞治療的療效高度依賴患者基線特征。以終末期腎病(ESRD)患者為例,盡管部分病例(如多發性骨髓瘤合并腎病)通過自體干細胞移植(ASCT)實現75%的透析脫離率,但整體ESRD患者中仍有約21%在3.4年內需重啟透析。
未來展望
盡管干細胞治療在晚期腎病中效果有限,但其作為綜合治療的一部分仍具價值:
- 延緩進展:對尚未進入終末期的患者,干細胞可能減緩GFR下降速度,推遲透析需求。
- 聯合療法:與基因編輯、生物材料或藥物(如抗纖維化劑)聯用,可能增強療效。
結語
干細胞治療為晚期腎病患者提供了從“維持生存”轉向“功能改善”的可能性,尤其在緩解并發癥、提升生存質量方面表現突出。然而,其核心局限在于無法逆轉結構性損傷,且長期療效受制于技術標準化與個體差異。未來需通過基因編輯、聯合療法及政策支持,推動該領域從實驗性探索向臨床普惠邁進,最終實現“延緩進展”與“功能代償”的雙重目標。
參考資料:
Chih-Chao Yang, Pei-Hsun Sung, Ben-Chung Cheng, Yi-Chen Li, Yi-Ling Chen, Mel S. Lee, Hon-Kan Yip, Safety and efficacy of intrarenal arterial autologous CD34+ cell transfusion in patients with chronic kidney disease: A randomized, open-label, controlled phase II clinical trial,?Stem Cells Translational Medicine, Volume 9, Issue 8, August 2020, Pages 827–838,?https://doi.org/10.1002/sctm.19-0409
Michael H Carstens, Nelson García, Sreedhar Mandayam, Biruh Workeneh, Indiana Pastora, Carlos Calderón, Kenneth A Bertram, Diego Correa, Safety of Stromal Vascular Fraction Cell Therapy for Chronic Kidney Disease of Unknown Cause (Mesoamerican Nephropathy),?Stem Cells Translational Medicine, Volume 12, Issue 1, January 2023, Pages 7–16,?https://doi.org/10.1093/stcltm/szac080
Matos Silva, Rita and Seixas, Filipa and Damasio, Inês and Freitas, Joana and Pinho Vaz, Carlos and Maximino Costa, José, Autologous Stem Cells Transplantation for Multiple Myeloma: Improving Chronic Kidney Disease?. Available at SSRN:?https://ssrn.com/abstract=4938667?or?http://dx.doi.org/10.2139/ssrn.4938667
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信