一張處方單的背后,是中國干細胞產業從實驗室到臨床的艱難跋涉與加速奔跑。
2025年6月5日,北京大學人民醫院血液科診室,黃曉軍院士提筆寫下一張特殊的處方單——國內首款獲批上市的干細胞藥物艾米邁托賽注射液由此進入臨床應用。這款名為“睿鉑生”的藥物將用于治療一名激素治療無效的急性移植物抗宿主病患者。

這一刻距離2013年3月該藥物首次提交臨床試驗申請已過去12年,漫長的等待折射出中國干細胞藥物審批的艱難歷程。
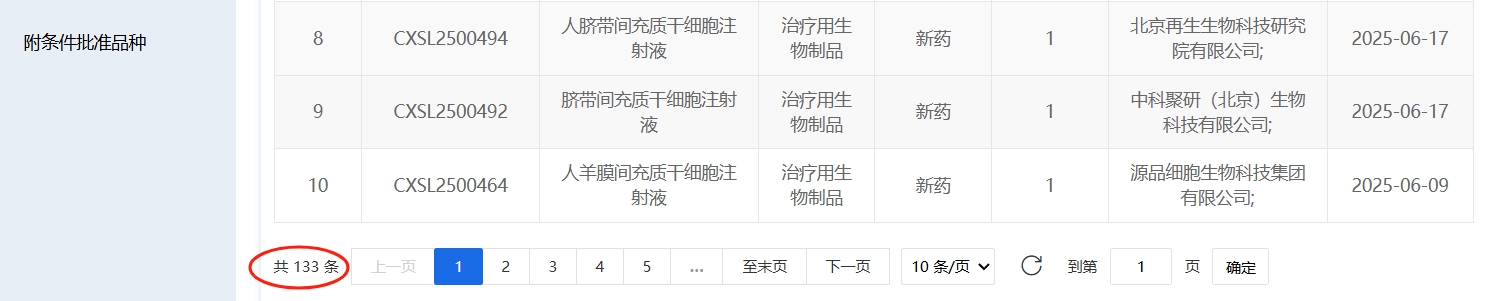
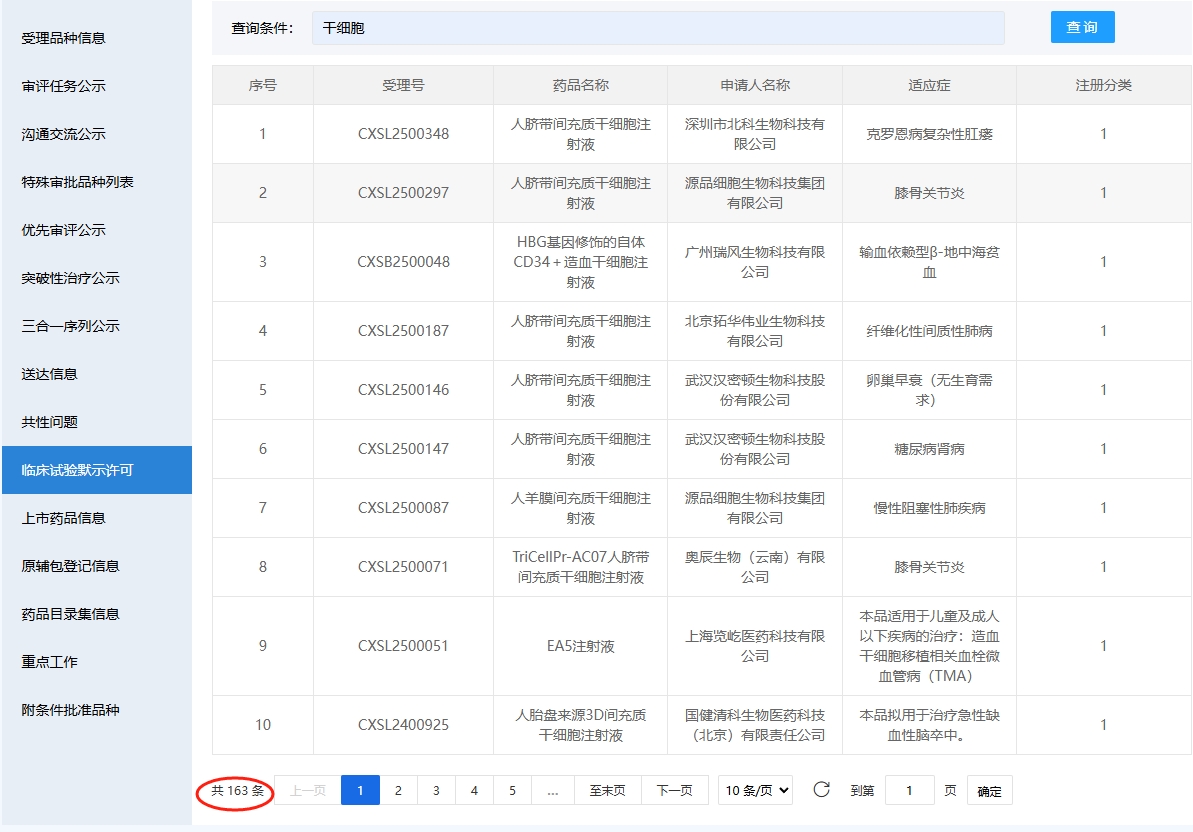
截至2025年7月30號,國內共有133款干細胞新藥臨床試驗獲得受理,其中2025年1-7月23款(1-5月13款,6-7月10款)。13款正在評審中。此外,截至到2025年7月30號,共計163款獲準默許進入臨床試驗(臨床試驗默示許可),其中2025年6-7月新增3款。160項臨床許可奠基下,2025年前5月干細胞新藥受理再加速:12款間充質干細胞產品領跑,造血干細胞破局
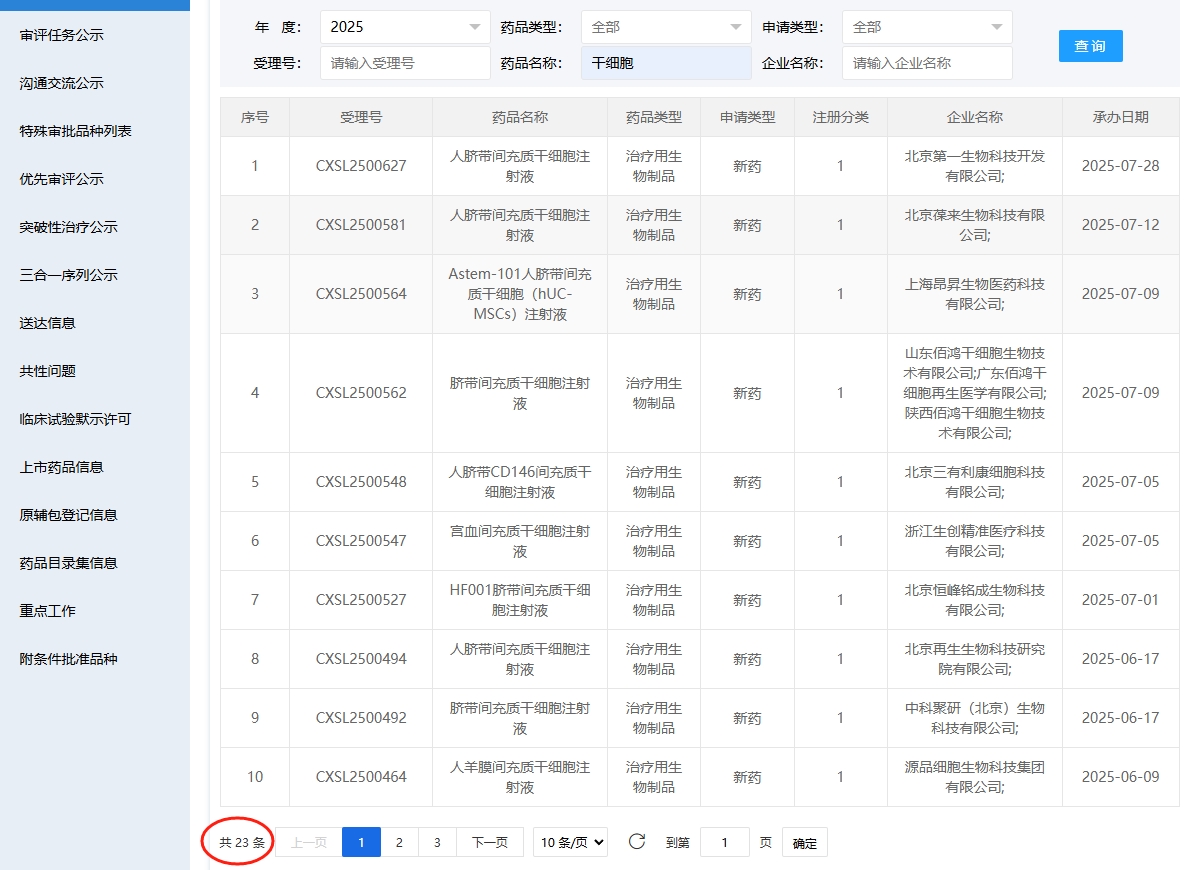
2025年以來,共有23款干細胞藥物臨床試驗申請獲得受理。
01:2025年6-7月干細胞新藥受理分析
一、受理概況與時間分布
時間集中性
- 6月:共受理5款(占比50%),包括源品生物(人羊膜MSC)、中科聚研和再生生物(臍帶MSC)等。
- 7月:共受理5款,集中在7月上旬(7月1日-9日)及下旬(7月28日),反映CDE審批節奏提速。
峰值節點:7月9日單日受理3款(昂昇生物、佰鴻、三有利康),凸顯企業申報窗口期趨同。
地域分布特征
- 北京主導:6家企業(如第一生物、葆來生物、三有利康)占比60%,依托中關村生物醫藥產業集聚優勢。
- 多區域協同:上海(昂昇生物)、山東(佰鴻)、浙江(生創醫療)等地企業同步發力,體現全國研發資源擴散。
二、技術路線與細胞來源創新
間充質干細胞(MSC)為主流
- 羊膜MSC(源品生物):全球唯一人羊膜組織來源,適應癥拓展至絕經綜合征(CXSL2500464)。
- 宮血MSC(生創醫療):利用經血干細胞,成本低且倫理風險小(CXSL2500547)
- 臍帶來源主導:7款(70%)采用臍帶MSC,因其免疫原性低、擴增能力強,標準化程度高。
特殊來源突破:亞群精準化:三有利康的“CD146+臍帶MSC”(CXSL2500548)通過標志物分選提升靶向性,適應癥潛力待披露。
現貨型”技術趨勢:10款藥物均屬異體通用型,無需個體化制備,支持規模化生產。如佰鴻干細胞(CXSL2500562)采用凍存技術降低運輸成本。
02 2025年6-7月受理的10項干細胞藥物臨床試驗申請詳細
新增受理1:2025年6月9號,源品細胞生物科技集團有限公司申報的“人羊膜間充質干細胞注射液”臨床試驗申請獲受理(受理號:CXSL2500464),這是該款細胞注射液第5次獲得受理。
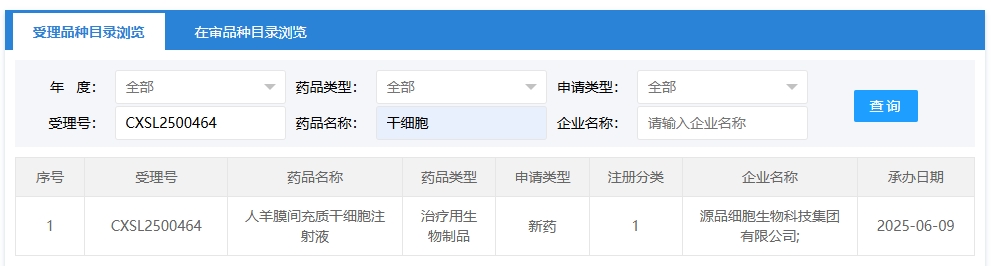
此前,該款細胞注射液已4次獲得受理:
(1)2024年4月獲得受理(受理號:CXSL2400258);
(2)2024年9月獲得受理(受理號:CXSL2400674);
(3)2025年1月獲得受理(受理號:CXSL2500087);
(4)2025年4月獲得受理(受理號:CXSL2500297);
其中三款干細胞新藥進入干細胞臨床試驗默示許可,適應癥分別是:膝骨關節炎、慢性阻塞性肺疾病、中重度急性呼吸窘迫綜合征。

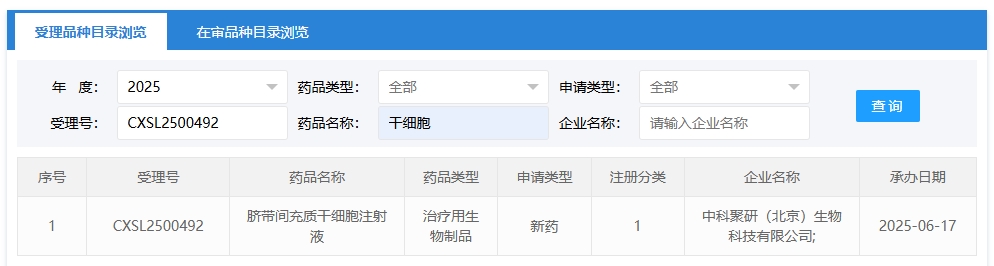
新增受理2:2025年06月17號,中科聚研(北京)生物科技有限公司申報的“臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500492),這是該款細胞注射液第1次獲得受理。
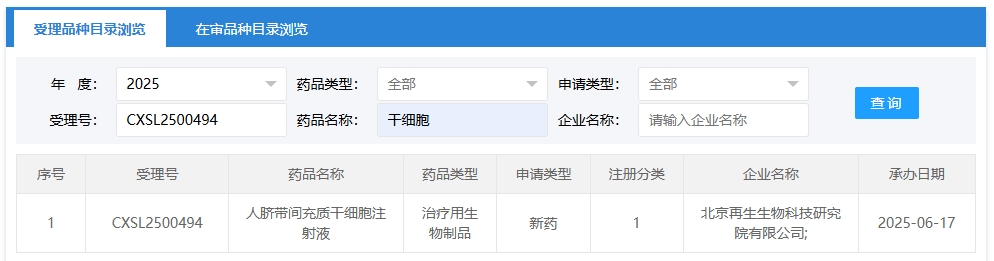
新增受理3:2025年06月17號,北京再生生物科技研究院有限公司申報的“人臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500494),這是該款細胞注射液第1次獲得受理。
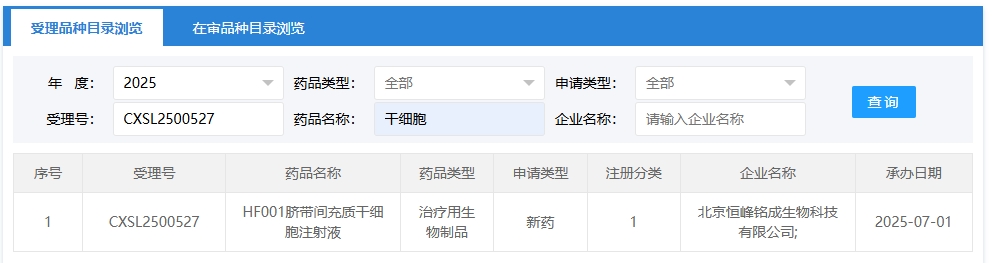
新增受理4:2025年07月01號,北京恒峰銘成生物科技有限公司申報的“HF001臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500527),這是該款細胞注射液第1次獲得受理。
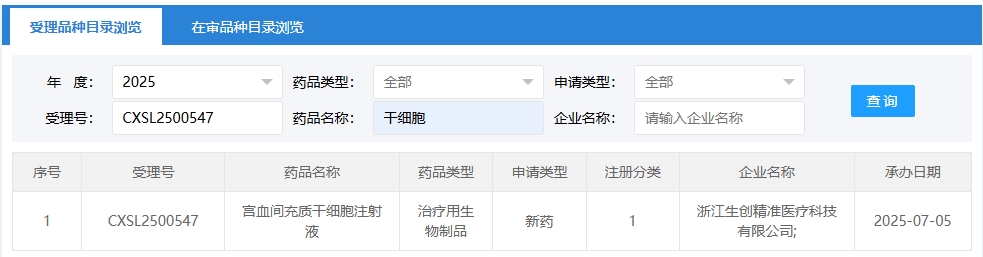
新增受理5:2025-07-05,浙江生創精準醫療科技有限公司申報的“宮血間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500547),這是該細胞注射液第4次獲得受理。
此前,該細胞注射已有3次獲得受理:
- 2021年03月03號,(受理號:CXSL2101001);
- 2024年02月26號,(受理號:CXSL2400156);
- 2025年05月22號,(受理號:CXSL2500412);
其中該款細胞注射液)獲得新藥臨床試驗默示許可,適應癥分別是:特發性肺纖維化,病毒導致的重癥肺炎。

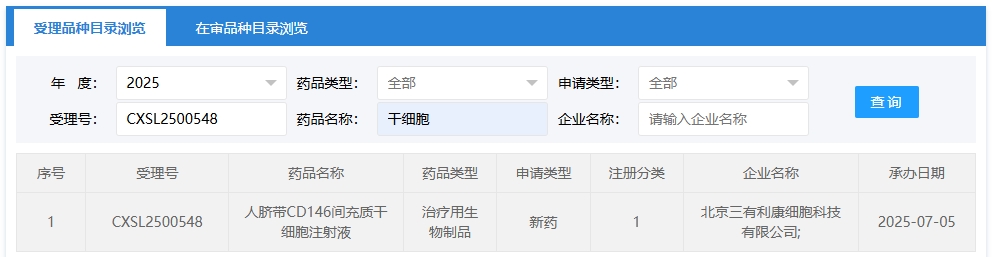
新增受理6:2025年07月05號,北京三有利康細胞科技有限公司申報的“人臍帶CD146間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500548),這是該款細胞注射液第1次獲得受理。
新增受理7:2025年07月09號,山東佰鴻干細胞生物技術有限公司聯合廣東佰鴻干細胞再生醫學有限公司,陜西佰鴻干細胞生物技術有限公司申報的“臍帶間充質干細胞注射液”的臨床試驗申請獲受理(受理號:CXSL2500562),這是該款細胞注射液第1次獲得受理。

新增受理8:2025年07月09號,上海昂昇生物醫藥科技有限公司申報的“Astem-101人臍帶間充質干細胞(hUC-MSCs)注射液”的臨床試驗申請獲受理(受理號:CXSL2500564),這是該款細胞注射液第1次獲得受理。

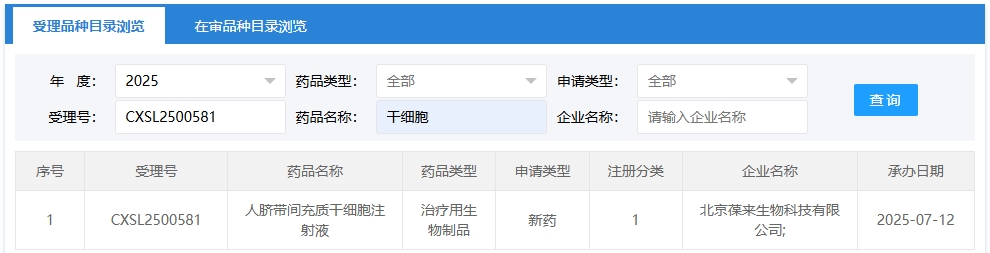
新增受理9:2025年07月12號,北京葆來生物科技有限公司申報的“人臍帶間充質干細胞注射液”的臨床試驗獲受理(受理號:CXSL2500581),這是該款細胞注射液第1次獲得受理。
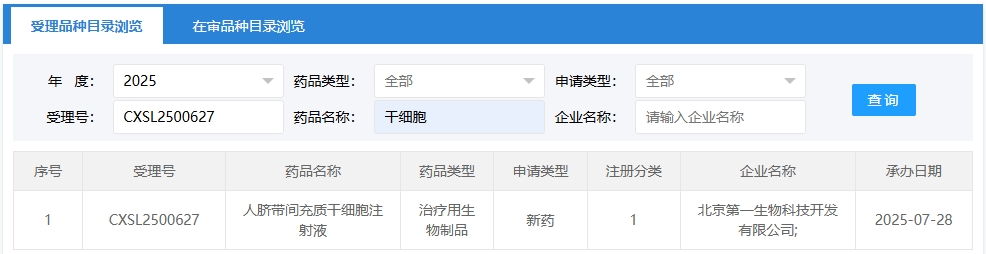
新增受理10:2025年07月28號,北京第一生物科技開發有限公司申報的“人臍帶間充質干細胞注射液”的臨床試驗獲受理(受理號:CXSL2500627),這是該款細胞注射液第1次獲得受理。
寫在最后:干細胞新藥研發的加速為中國患者帶來前所未有的希望。國家藥監局藥品審評中心副主任王濤介紹,自2017年至今,中國已批準133款干細胞藥品進入臨床試驗階段,適應證涵蓋血液、呼吸、心血管及自身免疫系統疾病。
隨著海南醫保試點推進、80%細胞類創新藥兩年內納入醫保的政策落地,干細胞療法正從富豪專屬走向大眾醫療。全球干細胞市場預計到2025年底達到2705億美元,近8年復合年增長率達13.8%。在這場生物科技競賽中,中國已從跟跑者變為并跑者,并在部分領域展現出領跑姿態。
參考資料:國家藥品監督管理局藥品審評中心(CDE)
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信