
2023年10月,國家藥品監督管理局再次彰顯了對生物醫藥創新的堅定支持,共計受理了5款一類新藥干細胞產品,其中包括4款人臍帶間充質干細胞注射液和1款造血干細胞注射液。其中兩款產品來自貴州和杭州,已在之前的文章中為大家詳細介紹。
干細胞新藥:天津、上海、深圳又各一款干細胞新藥IND獲受理
截至11月1日,又新增了天津、上海、深圳三大城市的干細胞新藥申請,它們成功獲得了進入臨床試驗階段的批準。
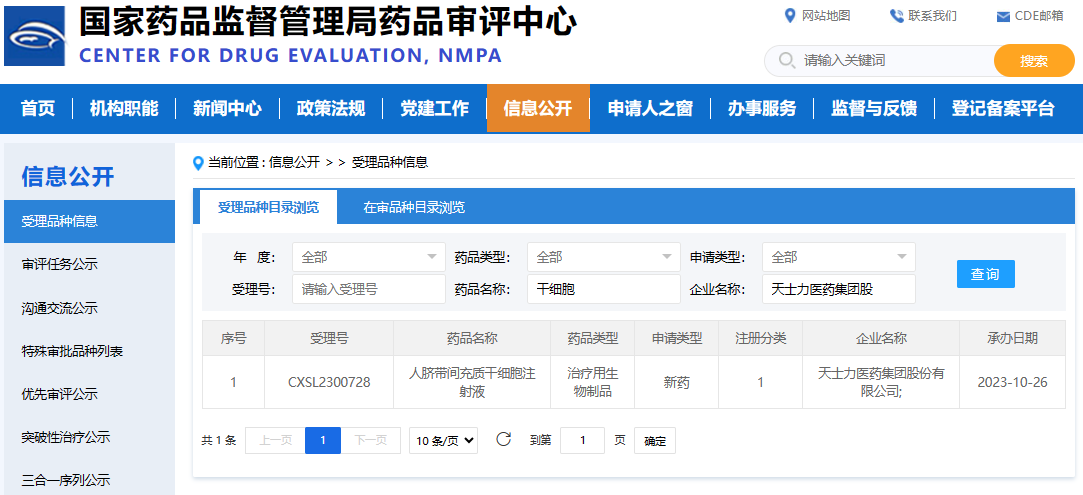
天津代表,天士力醫藥集團股份有限公司憑借其自主研發的人臍帶間充質干細胞注射液,成功獲得了國家藥品監督管理局的青睞,并于2023年10月26日被正式批準(批準編號:CXSL2300728)。為天津地區生物醫藥產業的發展提供了強勁的推動力。
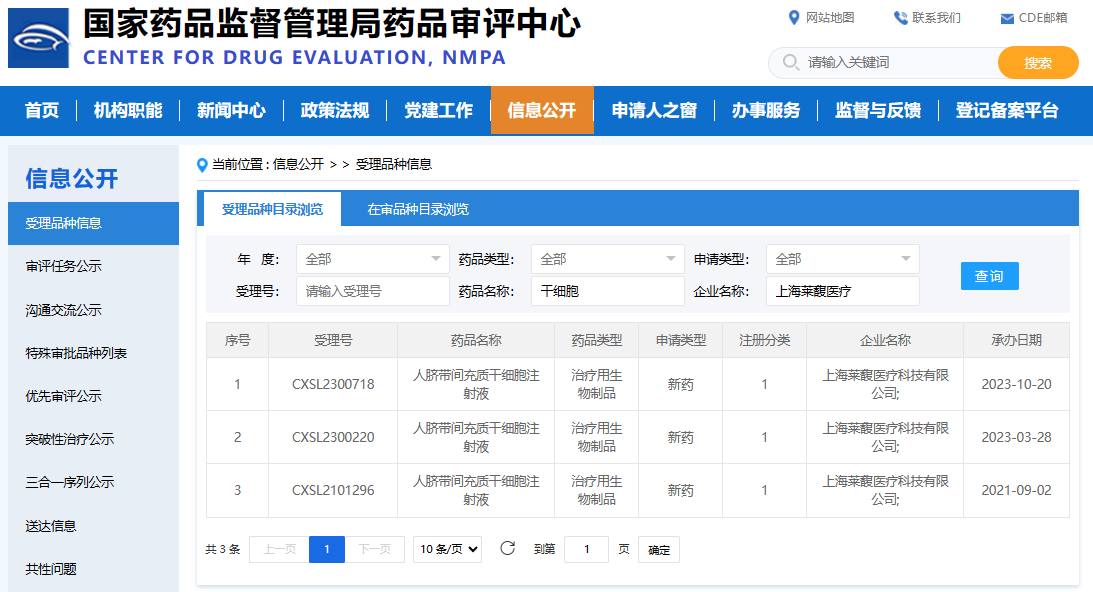
上海代表,上海萊馥醫療科技有限公司,其研發的人臍帶間充質干細胞注射液也在2023年10月20日獲得了批準,批準編號為CXSL2300718。這也是他們第三次獲得IND受理。
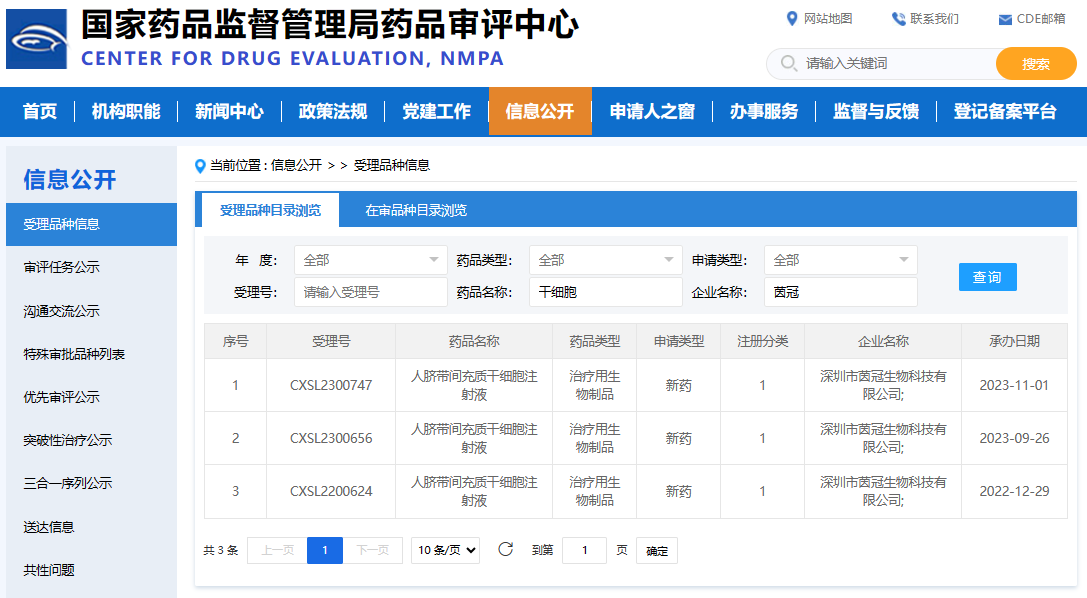
至于深圳,茵冠生物科技有限公司的表現更是令人矚目。短短一個多月的時間里,該公司便有兩款干細胞新藥IND相繼獲得國家藥品監督管理局的受理,其中人臍帶間充質干細胞注射液于2023年11月1日成功獲得受理(受理編號:CXSL2300747)。這不僅展現了茵冠生物在干細胞新藥研發領域的強大實力,也充分體現了其快速反應和創新能力。
這三座城市在干細胞新藥研發領域所取得的突破和成功,為中國生物醫藥產業的發展和創新提供了寶貴的經驗和示范。我們期待這些干細胞新藥能夠順利通過臨床試驗,早日造福廣大患者,為人類健康事業作出更大貢獻。
信息來源:國家藥品監督管理局藥品審評中心CDE
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信