在帕金森病治療領域,傳統療法的基石作用與創新療法的突破潛力始終交織著激烈的碰撞與深刻的思考。
干細胞治療帕金森病:傳統療法vs創新突破 | 頂尖學者解析爭議路徑與臨床曙光
近日,在國際權威期刊雜志《Parkinsonism&Related Disorders》發表了一篇“傳統與創新之爭III:干細胞治療帕金森病的前景依然光明”的文獻綜述[1]。

本文核心內容源自2024年第十屆帕金森病管理研討會的重磅學術交鋒。作為該領域年度頂級峰會,其”傳統與創新”辯論單元以干細胞療法治療帕金森病前景是否依然光明為議題,特邀克萊爾·亨奇克利夫(Claire Henchcliffe, MD, DPhil)與阿方索·法薩諾(Alfonso Fasano, MD, PhD)兩位權威學者展開正反方深度論戰。
這場閉幕階段的焦點辯論,不僅呈現了干細胞療法的突破性證據與現存技術瓶頸的尖銳碰撞,更以思辨張力映射出神經再生醫學的演進方向。
會上,醫學博士、哲學博士克萊爾·亨奇克利夫 (Claire Henchcliffe) 持支持立場,而醫學博士、哲學博士阿方索·法薩諾 (Alfonso Fasano) 則持反對立場。以下是辯論內容的節選。

雙方觀點鮮明,論據充分,這場高水平的學術辯論,不僅揭示了干細胞療法在帕金森病治療道路上所面臨的曙光與挑戰并存,更以其深刻的思辨性,有力地重申了:盡管前路充滿荊棘,干細胞療法為帕金森病患者帶來革命性治愈希望的光芒。
同意干細胞治療帕金森病前景光明的觀點
引言:干細胞在帕金森病研究中具有多重應用價值,但本次辯論我將聚焦于利用干細胞衍生細胞產品以修復帕金森病中缺失的多巴胺能神經輸入這一潛力領域。盡管非運動癥狀的重要性不容忽視,鑒于當前該領域的主要突破集中于運動系統,我的論述將以此為重心。
采用多能干細胞(PSC)衍生的多巴胺能細胞的核心理論在于:通過手術將其植入殼核,可重建因帕金森病喪失的多巴胺能神經輸入,從而改善致殘性運動癥狀。當前標準術式采用雙側額葉入路,通過多通道技術和分散式細胞沉積以實現最均勻的空間分布——但關于最佳靶點與手術方案的爭論持續存在。
我們仍需深入探索:后入路手術正在推進中,臨床前研究亦提示向黑質區域移植細胞的可行性。
干細胞研究治療帕金森病的歷史
早期異體細胞移植的探索困境:在現當代干細胞技術成熟前,研究者曾嘗試多種異體細胞源但均告失敗:腎上腺髓質嗜鉻細胞移植因高致死致殘率被棄用;頸動脈體球細胞因療效不穩定終止;視網膜色素上皮細胞雖初顯潛力,終因細胞存活率低下未獲成功。這些探索雖未達臨床預期,卻為后續研究排除了關鍵技術盲區。
胚胎組織移植的悖論與啟示:人胚胎中腦組織成為最系統的移植源,國際開放標簽研究證實其可改善運動功能、降低用藥量且具手術可行性,但美國假手術對照試驗未達主要終點。更關鍵的是,15%-56%患者出現移植后”關期”異動癥,現普遍歸因于移植物中混雜的5-羥色胺能神經元前體。
盡管項目終止,這些研究奠定了細胞移植試驗的方法學框架,并驗證了多巴胺能神經元替代療法的根本理論邏輯。
干細胞技術的革命性破局:如圖1所示,多能干細胞(PSC)技術近年取得突破性進展:2017年紐約/波士頓完成首例iPSC自體移植,2018年京都實現首例iPSC異體移植,2021-2023年更啟動多中心臨床試驗。
相較早期方案,PSC衍生細胞具備標準化生產、純度可控及免疫匹配優化三重優勢,標志著干細胞療法正式進入加速兌現臨床價值的黃金期。

臨床前背景研究
臨床前研究為干細胞療法提供了強效驗證:Kriks團隊2011年率先實現人胚胎干細胞向標準A9型多巴胺神經元定向分化,證實移植細胞可改善PD動物模型運動功能且具跨物種存活性;其后續研究通過光遺傳學技術精準操控多巴胺釋放,直接論證了功能改善的神經傳導機制。
更關鍵的是,該領域已形成三重復合驗證體系——在多物種模型中嚴格檢驗細胞功能療效,通過致瘤風險測試(如異常增殖試驗)、脫靶效應監測及免疫抑制環境評估,全面構建起支撐臨床轉化的科學基石。
全球合作努力促進帕金森病干細胞療法的開發
我們意識到,不僅要優化各個團隊對潛在新療法的開發,還要加強該領域的合作。一個名為“全球力量藥物開發”(GForce-PD)的小組成立了。這種合作使我們能夠協調各方努力,例如在方案和隊列特征、結果測量和生物標志物方面。
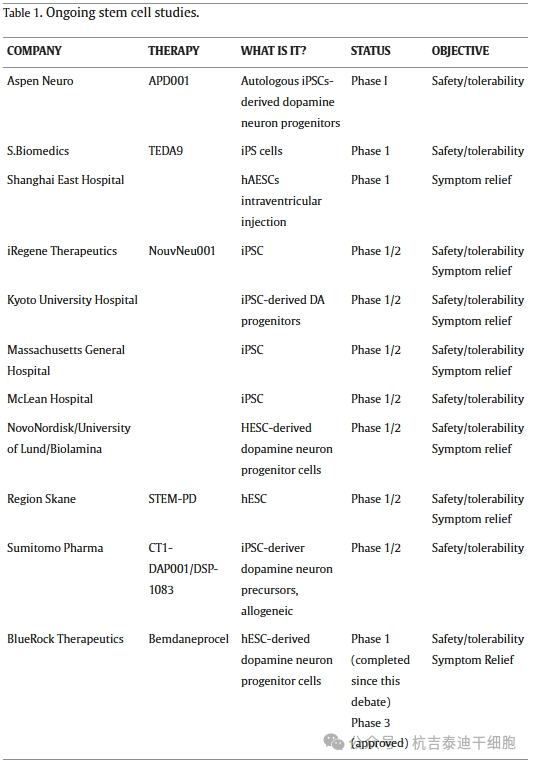
目前,該領域的研究數量正在不斷增加(表1),顯示出不斷增長的勢頭。
首例自體細胞移植實踐:2020年在《新英格蘭醫學雜志》上發表了一篇“個性化iPSC衍生多巴胺祖細胞治療帕金森病”的研究報告,這是全球首例開展的自體誘導多能干細胞移植治療帕金森病的臨床試驗。試驗報告了將患者來源的中腦多巴胺能祖細胞植入一名特發性帕金森病患者的案例,通過分階段向患者雙側殼核立體定向植入400萬自體源多巴胺神經元。

臨床結果表明:這些細胞不具有免疫原性。這些細胞被植入一名帕金森病患者的殼核(先植入左半球,然后植入右半球,間隔6個月),無需免疫抑制。使用氟-18-L-二羥基苯丙氨酸的正電子發射斷層掃描 (PET) 表明移植物存活。術后帕金森病癥狀的臨床指標在植入后18至24個月內趨于穩定或改善。
盡管單一病例的解讀價值有限,但其突破性示范價值在于首次完整實現”從細胞開發到人體移植”全流程閉環,證實該體系具備可操作性、安全性且無顯著副作用。
干細胞治療帕金森病正在進行中的研究
一、國內研究進展
自體干細胞移植臨床突破
瑞金醫院(上海):2025年3月完成全國首例GCP級自體干細胞移植手術。團隊通過高通量譜系示蹤技術,精準富集多巴胺能神經前體細胞,移植至66歲晚期PD患者腦內,術后隨訪顯示運動功能顯著改善。
士澤生物(XS-411注射液):全球首個“現貨型”iPSC衍生多巴胺能神經前體細胞藥物,2025年1月同步獲中美臨床試驗批準。首例患者治療后12個月,MDS-UPDRS評分降低40%,無嚴重副作用,計劃2028年提交新藥申請。
創新性臨床試驗設計
華山醫院隨機雙盲試驗:2025年4月啟動國內首個iPSC治療早發性PD的隨機雙盲對照試驗,由王堅、陳亮教授牽頭,旨在提供最高級別臨床證據。
無創給藥探索(協和醫院):經鼻黏膜移植神經干細胞,利用嗅覺神經通道繞過血腦屏障,減少手術創傷,已進入擴大臨床試驗階段。
新型治療策略
外泌體療法:仁濟醫院團隊探索干細胞來源外泌體治療PD,通過降解α-突觸核蛋白、抗炎及促進神經再生,聯合間充質干細胞增強療效。
iPSC衍生間充質干細胞(湖南大學):2025年1月研究證實其可保留紋狀體多巴胺,改善PD小鼠肌肉強度和運動功能。
二、國外研究進展
日本京都大學(iPSC來源):關鍵臨床試驗成果:I/II期試驗中,7例患者接受雙側腦移植,24個月內無腫瘤或嚴重副作用,多巴胺生成增加44.7%,4/6患者停藥后運動癥狀改善。
住友制藥正推動商業化申請。
美國BlueRock Therapeutics(hESC來源):I期試驗(bemdaneprocel)對12例患者移植高/低劑量細胞,18個月后無免疫排斥或運動障礙,高劑量組MDS-UPDRS評分提高23分。2025年1月獲FDA批準進入III期試驗。
技術優化與挑戰應對
- 哈佛醫學院&韓國科學技術院:2025年2月開展自體iPSC治療I期試驗,強調個體差異影響療效,需定制化細胞制備。
- 宿主腦環境優化:研究聚焦移植后細胞存活率低的問題,發現TNF-α介導的炎癥反應是關鍵因素,通過抑制p53通路可提升細胞存活。
結論:總而言之,目前正在加緊努力,開發有效且具有競爭力的再生醫學方法治療帕金森病。在多種動物模型中進行的臨床前研究表明,我們可以恢復黑質紋狀體信號輸入并緩解運動功能障礙。在當今先進的干細胞技術出現之前,先前的方法可能由于細胞產品的局限性而失敗,但事實證明,它們為學習如何開發臨床試驗方法提供了一個強大的平臺。
干細胞如今使我們能夠克服先前的局限性,早期臨床試驗不僅滿足了安全性和有效性的要求,而且還利用神經影像學生物標志物獲得了積極的發現。盡管在評估臨床效果時需要謹慎,但積極的信號已經出現。因此,干細胞療法的前景光明,并且前景將持續看好。
不同意干細胞治療帕金森病的前景“依然光明”的觀點
首先,讓我們來談談干細胞療法在帕金森病治療中的前景“依然光明”這一說法。分析已發表的論文數量(圖2),我們可以看到大量的綜述文章,但原創研究文章卻很少。正如我的同辯者所說,目前開展的研究在數據收集、結果評估、手術技術和免疫抑制劑的選擇方面缺乏標準化。
例如,不同公司采用的手術方法各不相同。例如,BlueRock采用類似于深部腦刺激的策略,而Aspen Neurosciences則采用枕骨入路。

干細胞治療帕金森病的前景并未“越來越光明”
技術迭代的虛像與實相:法薩諾博士駁斥”前景光明論”的核心依據在于技術代際缺陷:取代胚胎中腦組織(因倫理與技術缺陷淘汰)的工程化細胞,雖理論上解決細胞來源問題,卻陷入重編程效率<10%、移植存活率折損>70%及標準化生產不可控三重泥潭。這些底層技術瓶頸使”光明前景”僅停留于理論推演。
臨床證據鏈的致命斷層:他揭示當前研究存在證據金字塔坍塌風險:全球范圍內Ⅲ期/Ⅳ期臨床試驗完全空白,大多數是Ⅱ期試驗,且關鍵缺陷在于普遍缺失假手術對照組。帕金森病治療中安慰劑效應高達40%(侵入性治療尤甚),使現有”陽性結果”的臨床可信度遭受根本性質疑。
科學預言史的警示維度:通過醫學史三大著名誤判案例(X射線否定論/感冒滅絕論/150歲壽命論),法薩諾構建科學預測不確定性框架。在此視角下,亨奇克利夫博士的樂觀預言需接受嚴格審視——正如核醫學奠基人赫維西所言:”醫學突破從不在預言中誕生,而在實驗室血淚里結晶”。干細胞療法真正曙光,唯待技術瓶頸突破與嚴謹臨床試驗雙重驗證。
干細胞治療帕金森病的局限性有哪些?
干細胞療法面臨多重局限:療效不確定性、技術效率低下、免疫排斥反應、副作用風險及規模化挑戰,輔以倫理與監管難題。盡管既往研究已探討部分問題,其仍是臨床轉化的核心壁壘。
一、移植效能的底層制約
干細胞療法面臨三重效率鴻溝:
- 參數盲區——最佳細胞類型、劑量及干預時機仍無共識;
- 存活率極限——僅15%移植細胞可存活,且單側殼核再神經化需10萬級細胞規模(該數據源于理論模型未獲實證);
- 病變微環境侵蝕——神經退行性環境導致移植細胞功能異常:典型案例如移植14年后細胞酪氨酸羥化酶(TH?)/囊泡單胺轉運體2(VMAT2?)陽性卻缺失多巴胺轉運體(DAT?),更存在α-突觸核蛋白宿主-移植物病理傳遞風險。這些證據共同揭示:退行性腦實質構成持續性毒性微環境。
二、免疫悖論與基因困局
免疫學挑戰是另一個令人擔憂的問題,因為iPSC對身體來說是外來物質,它們的植入會引發免疫反應。最初,這是由于手術創傷,后來則是由于外來細胞的存在。克服這個問題的一種方法是對iPSC進行基因改造,使其不易被免疫系統識別。
然而,這會帶來腫瘤形成的風險,而且這種風險可能在移植數年后才會顯現出來。另一種策略是將調節性T細胞與iPSC一起植入,但這又增加了治療的復雜性和多變性。雖然源自患者自身細胞的自體多能干細胞可以避免一些免疫排斥問題,但它們仍然可能攜帶最初導致疾病的相同遺傳功能障礙。
三、技術定位的本質偏差
如果干細胞移植在未來獲得批準,其可行性和可擴展性將成為主要關注點。——公眾與媒體普遍誤讀其為”腦修復革命”,實則為單一多巴胺能細胞替代(不足整體病理機制的5%)。這種認知落差引發替代療法優勢拷問:深部腦刺激(DBS)與左旋多巴泵雖非靶向遞送多巴胺,卻規避了細胞治療的復雜性。
如果我們想要探索將多巴胺直接輸送到大腦,為什么不探索輸送多巴胺本身而不是細胞的方案呢?Inbrain Pharma目前正在探索通過泵將無氧多巴胺(以防止分子氧化降解)直接輸送到心室,以有效改善運動并發癥。當細胞移植尚未證明不可替代性時,這些成熟技術構成強效競爭。
四、個體化醫療與倫理雙重困局
正如亨奇克利夫博士在演講中指出的那樣,帕金森病并非一種單一的疾病,我們必須更好地實現個性化和個體化治療。患者之所以參加這些試驗,是因為他們內心深處認為這能解決問題。但由于患者之間存在巨大的異質性,并非所有人都能從這些細胞療法中受益。
圍繞干細胞移植的倫理問題也使該領域變得復雜。為了控制安慰劑效應,需要進行假手術對照,但這會引發嚴重的倫理困境。這些擔憂使得即使是該領域的專家也難以就研究設計達成共識。此外,FDA和保險公司的審批流程將在很大程度上取決于這些試驗的設計和結果。
結論
盡管干細胞治療帕金森病仍面臨細胞存活率、免疫排斥及個體化適配等科學深水區,但干細胞治療帕金森病的曙光正穿透迷霧——iPSC自體移植的首次人體驗證、多能干細胞定向分化的基因調控突破、以及全球十余項臨床試驗的加速推進,共同構筑起神經再生醫學的里程碑。
這條路或許漫長,但每一例成功的細胞案例都在證明:通過重塑大腦的化學語言來逆轉時間對神經的侵蝕,已從科幻走向實驗室,正從實驗室邁向病床。干細胞療法承載的不僅是多巴胺能神經元的重生,更是數百萬帕金森病患者重獲生命主動權的終極希望。
參考資料:[1]:https://www.prd-journal.com/article/S1353-8020(25)00590-5/abstract
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信